-
下列属于放热反应的是( )
A.铝和盐酸反应 B.焦炭和二氧化碳共热
C.石灰石的分解 D.氯化铵与氢氧化钡反应
难度: 简单查看答案及解析
-
下列热化学方程式中,ΔH的绝对值能表示可燃物的燃烧热的是( )
A.C(s)+O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
B.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
D.CO(g)+O2(g)===CO2(g) ΔH=-283 kJ·mol-1
难度: 简单查看答案及解析
-
下列叙述中,正确的是( )
①电解池是将化学能转变成电能的装置 ②原电池是将电能转变成化学能的装置 ③金属和石墨导电均为物理变化,电解质溶液导电是化学变化 ④不能自发进行的氧化还原反应,通过电解的原理有可能实现 ⑤电镀过程相当于金属的“迁移”,可视为物理变化
A.①②③④ B.③④
C.③④⑤ D.④
难度: 简单查看答案及解析
-
在一定温度下,用铂电极电解饱和硫酸钠溶液,对电解质溶液的判断正确的是( )
A.不会有晶体析出 B.浓度变大 C.浓度变小 D.pH不变
难度: 简单查看答案及解析
-
不管化学反应过程是一步完成还是分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)===H2O(l) ΔH1=-Q1 kJ·mol-1①
C2H5OH(g)===C2H5OH(l) ΔH2=-Q2 kJ·mol-1②
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-Q3 kJ·mol-1③
若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
A.(Q1+Q2+Q3) kJ B.[0.5(Q1+Q2+Q3)] kJ
C.(0.5Q1-1.5Q2+0.5Q3) kJ D.(1.5Q1-0.5Q2+0.5Q3) kJ
难度: 简单查看答案及解析
-
常温下,取0.3 mol/LHY溶液与0.3 mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH = 9,则下列说法(或关系式)正确的是 ( )
A.混合溶液中由水电离出的c(OH-)=10-9 mol/L
B.溶液中离子浓度由大到小的顺序为 c(Y-)> c(Na+) > c(OH-)>c(H+)
C.c(OH-)-c(HY)=c(H+)=1×10-9mol/L
D.c(Na+)=c(Y¯)+c(HY) =0.3 mol/L
难度: 简单查看答案及解析
-
实验室欲配制一种仅含四种离子(不考虑来源于水电离的离子)的溶液,且溶液中四种离子的浓度均为1mol/L,能达到此目的的是 ( )
A.Na+、K+、Br-、NO3- B.Ba2+、Mg2+、SO42-、Cl-
C.ClO-、I-、K+、Na + D.H+、 K+、 Cl-、 CO32-
难度: 简单查看答案及解析
-
广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果都是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述观点,下列说法错误的是( )
A.CaO2的水解产物是Ca(OH)2和H2O2
B.(CH3)3COMgBr的水解产物是(CH3)3COH和Mg(OH)Br
C.PCl3的水解产物是PH3和HClO
D.A1(C2H5)3的水解产物是Al(OH)3与C2H6
难度: 简单查看答案及解析
-
下列关于金属腐蚀与防护的说法正确的是( )
A.金属腐蚀就是金属失去电子被还原的过程
B.铝制品的耐腐蚀性强,说明铝的化学性质不活泼
C.将海水中钢铁闸门与电源的负极相连,可防止闸门被腐蚀
D.钢铁锈蚀时,铁原子失去电子成为Fe3+,而后生成Fe(OH)3,再部分脱水成为氧化铁的水合物
难度: 简单查看答案及解析
-
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
A.某溶液中由水电离出的c(OH-) = 1×10-amol·L-1,若a>7时,则该溶液的pH一定为14-a
B.等体积、等物质的量浓度的Na2SO3溶液与NaHSO3溶液混合:
c(Na+) = c(SO32-) + c(HSO3-) + c(H2SO3)
C.将0.2mol·L-1的某一元酸HA溶液和0.1mol·L-1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:2c(OH-)+c(A-)=2c(H+)+c(HA)
D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(Na+)>2c(R2-)+c(HR-)
难度: 简单查看答案及解析
-
下列各离子①R- ②R+ ③ R3+ ④RH4+ ⑤ RH-(R表示不同的元素)都有10个电子,其中不会破坏水的电离平衡的有( )
A.①②③ B.仅有② C.②③④ D.①②⑤
难度: 简单查看答案及解析
-
下列各组离子,在所给条件下一定能大量共存的是( )
A.在pH=1溶液中:Fe2+、K+、 NO3-、Cl—
B.使紫色石蕊试液变红色的溶液中:K+、Na+、Ca2+、HCO3-
C.在含有大量AlO2—的溶液中: NO3-、Na+、Cl-、Al3+
D.在由水电离出的c(H+)•c(OH—)=10—26的溶液中:K+、Na+、Cl—、SO42-
难度: 简单查看答案及解析
-
X、Y、Z三种气体,取X和Y按2∶1的物质的量之比混合,放入固定体积的密闭容器中发生如下反应:X + 2Y
2Z,达到平衡后,X的转化率不可能为( )
A.10% B.15% C.20% D.25%
难度: 简单查看答案及解析
-
已知一定温度下,2X(g)+Y(g)
mZ(g) ΔH=-a kJ·mol-1(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度恒定的条件下,向密闭容器甲中通入2 mol X和1 mol Y,达到平衡状态时,放出热量b kJ;向密闭容器乙中通入1 mol X和0.5 mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值或关系正确的是( )
A.m=4 B.a=b C.a< D.m≤2
难度: 简单查看答案及解析
-
用惰性电极电解2L饱和氯化钠溶液,经过一段时间以后,电解液的pH上升至13(Kw=10-14),则电解过程中两极上共产生的气体在标准状况下体积为( )
A.2.24L B.4.48L C.1.12L D.11.2L
难度: 简单查看答案及解析
-
如图为一恒压容器。在恒定温度下,将1 mol N2和3 mol H2混合后由A口快速充入容器,封闭A。反应N2+3H2
2NH3在t1时刻达到平衡;t2时刻再从A口快速充入一定量NH3,封闭A;t3时刻重新达到平衡至t4。在0→t4时间内混合气中NH3的体积分数(纵坐标)随时间(横坐标)变化的曲线正确的是( )
难度: 简单查看答案及解析
-
在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g)
Fe(s)+CO2(g) △H=a kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是( )
A. 若生成1 mol Fe,则吸收的热量小于a kJ
B. 若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动
C. 若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态
D. 达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L
难度: 简单查看答案及解析
-
用0.01 mol/L H2SO4滴定0.01mol/L NaOH溶液,中和后加水至100ml,若滴定时终点判断有误差:①多加1滴H2SO4;②少加1滴H2SO4;(设1滴为0.05ml)则①和②c(H+)的比值是( )
A. 10 B. 50 C. 5×103 D. 104
难度: 简单查看答案及解析
-
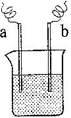
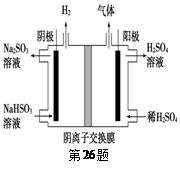
固体电解质是具有与强电解质水溶液的导电性相当的一类无机固体。这类固体通过其中的离子迁移进行电荷传递,因此又称为固体离子导体。目前固体电解质在制造全固态电池及其它传感器、探测器等方面的应用日益广泛。如RbAg4I5晶体,其中迁移的物种全是Ag+,室温导电率达0.27Ω-1·cm-1。利用RbAg4I5晶体,可以制成电化学气敏传感器,下图是一种测定O2含量的气体传感器示意图。被分析的O2可以透过聚四氟乙烯薄膜,由电池电动势变化可以得知O2的含量。在气体传感器工作过程中,下列变化肯定没有发生的是( )
A.4AlI3+3O2==2Al2O3+6I2 B.I2+2Ag++2e-=2AgI
C.Ag-e-=Ag+ D.I2+2Rb++2e-=2RbI
难度: 简单查看答案及解析
-
下列装置图或曲线图与对应的叙述相符的是( )

A.图1:负极反应是Fe-2e-=Fe2+
B.图2:酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去
C.图3:可表示乙酸溶液中通入氨气至过量过程中溶液导电性(I )的变化
D.图4:可表示在恒容密闭容器中反应“2SO2(g) +O2(g)
2SO3(g) ΔH<0”的平衡常数K正、K逆随温度的变化
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.用坩埚灼烧MgCl2·6H2O的反应式 MgCl2·6H2O
MgCl2+6H2O
B.根据下表提供的数据,等物质的量浓度的NaClO、NaHCO3混合溶液中,有c(HCO3-)>c(ClO-)>c(OH-) 。
化学式
电离常数
HClO
K1=3×10-8
H2CO3
K1=4.3×10-7
K2=5.6×10-11
C.常温下,将pH=2的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一。
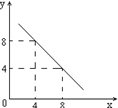
D.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,溶度积常数Ksp=c(Ba2+)·c(SO42-)。则加入 Na2SO4可使溶液由a点变到b点;通过蒸发可以使溶液由d 点变到c 点。

难度: 简单查看答案及解析
-
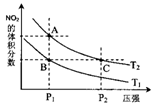
在容积一定的密闭容器中,可逆反应( )
A2(g)+ B2(g)
xC(g) 符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是

A.P3<P4,Y轴表示A2的转化率 B.P3<P4,Y轴表示A2的浓度
C.P3>P4,Y轴表示混合气体的密度 D.P3>P4,Y轴表示混合气体的平均摩尔质量
难度: 简单查看答案及解析