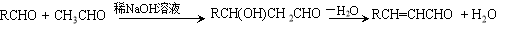-
化学与生产、生活密切相关。下列说法不正确的是
A.闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺
B.四大发明之一黑火药是由硫黄、硝石、木炭三种物质按一定比例混合制成
C.侯氏制碱法的工艺过程中应用了物质溶解度的差异
D.打磨磁石制作指南针为化学变化
难度: 简单查看答案及解析
-
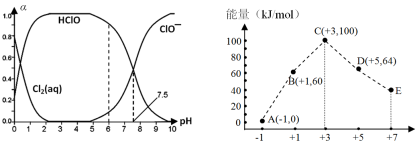
25℃时,下列各组离子在指定溶液中可能大量共存的是
A.无色溶液中: Al3+、NH4+、Cl—、S2—
B.由水电离得到的c(H+)=1×10-13mol·L-1的溶液中:Mg2+、Cu2+、SO42-、NO3—
C.0.1 mol·L-1 FeCl3溶液中: K+、Na+、AlO2—、SCN—
D.中性溶液中可能大量存在Fe3+、K+、Cl—、SO42-
难度: 中等查看答案及解析
-
为提纯下列物质(括号内为杂质),选用的试剂或方法有错误的是
物质
试剂
分离方法
A
硝酸钾(氯化钠 )
蒸馏水
降温结晶
B
氢氧化铁胶体(Fe3+)
蒸馏水
渗析
C
甲烷(乙烯)
酸性高锰酸钾溶液
洗气
D
乙醇(水)
生石灰
蒸馏
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式的是
A.Fe3O4溶于足量稀HNO3中:Fe3O4+8H+=Fe2++2Fe3++4H2O
B.NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3- +Ba2++OH-=BaCO3↓+H2O
C.将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O=HClO+ HSO3-
D.将0.2 mol·L-1 NH4Al(SO4)2溶液与0.3 mol·L-1 Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
难度: 困难查看答案及解析
-
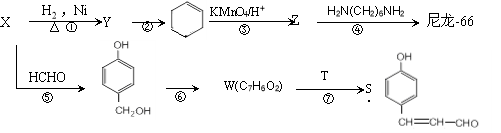
X、Y、Z、W有如右图所示的转化关系,已知焓变:ΔH=ΔH1+ΔH2,则X、Y不可能是
A.C、CO B.AlCl3、Al(OH)3
C.Fe、Fe(NO3)2 D.S、SO3
难度: 中等查看答案及解析
-
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22,下列说法正确的是
A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B.由X、Y和氢三种元素形成的化合物中只有共价键
C.物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
难度: 中等查看答案及解析
-
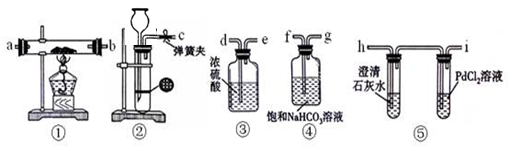
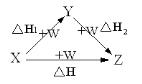
下列实验装置不能达到实验目的的是
A.比较非金属性强弱:S > C > Si
B.分离CH3COOC2H5和饱和碳酸钠溶液
C.观察纯碱的焰色反应
D.比较Na2CO3和NaHCO3的热稳定性
难度: 中等查看答案及解析
-
下列化合物的同分异构体数目为7种的是(不考虑立体异构)
A.丁醇 B.丁烯 C.一氯戊烷 D.己烷
难度: 困难查看答案及解析
-
下列说法不正确的是
A.Al2O3用作耐火材料、Al(OH)3用作阻燃剂
B.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
C.碳素钢的主要成分是铁碳合金、司母戊鼎的主要成分是铜锡合金
D.盛放NaOH溶液的磨口玻璃瓶要用橡胶塞
难度: 简单查看答案及解析
-
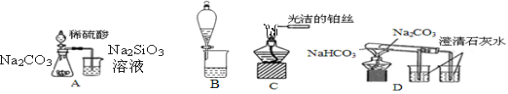
综合如图判断,下列说法正确的是
A.装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-=Fe2+
B.装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
C.装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动
D.放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大
难度: 中等查看答案及解析
-
设NA 为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,11.2L HF中含有分子的数目为0.5NA
B.0.1molFe与少量氯气反应生成FeCl2,转移电子数为0.2NA
C.1.4g 由乙烯和环丙烷组成的混合物中含有原子的数目为 0.3NA
D.0.1 mol·L-1碳酸钠溶液中含有CO32-离子数目小于0.1 NA
难度: 中等查看答案及解析
-
向质量分数为2a%,体积为10 mL,物质的量浓度为c1 mol·L-1的稀H2SO4中加入V mL 的水,使之质量分数变为 a%,此时物质的量浓度为c2 mol·L-1,则下列关系正确的是
A.V>10, 2c2=c1 B.V<10,2c2﹤c1
C.V>10,2c2<c1 D.V>10, 2c2>c1
难度: 困难查看答案及解析
-
向含1mol Na2CO3的饱和溶液中缓缓通入CO2气体使之充分反应,下列图像表示正确的是
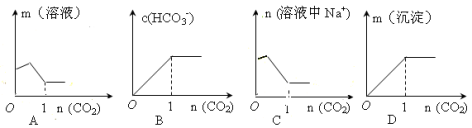
难度: 中等查看答案及解析
-
海水是重要的资源,可以制备一系列物质。
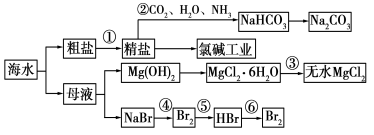
下列说法正确的是
A.步骤②中,应先通CO2,再通NH3
B.步骤③中可将MgCl2·6H2O晶体在空气中直接加热脱水
C.步骤④、⑤、⑥反应中,溴元素均被氧化
D.除去粗盐中SO、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸
难度: 中等查看答案及解析