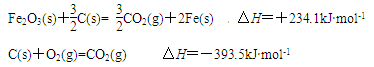-
化学与生活、社会密切相关。下列说法不正确的是
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了防止白色污染
难度: 中等查看答案及解析
-
铋(Bi)在医药方面有重要应用。下列关于
和
的说法正确的是
A.
和
是同一种核素 B.
和
的中子数相同
C.
和
互称为同位素 D.
和
的质量数相同
难度: 中等查看答案及解析
-
以NA表示阿伏加德罗常数,下列说法正确的是
A.0.1mol Fe与足量盐酸反应,转移的电子数为0.3NA
B.28gCO中所含的原子数为2NA
C.0.1mol/LNa2CO3溶液中,含有CO32— 数为0.1NA
D.标况下,22.4L苯的分子数为NA
难度: 中等查看答案及解析
-
在pH=0的溶液中,能大量共存的离子组是
A.Na+、Mg2+、NO3-、SO42- B.K+、Ca2+、CH3COO-、HCO3-
C.Fe2+、Na+、 Cl-、 NO3- D.Ba2+、AlO2-、K+、SO42-
难度: 中等查看答案及解析
-
配制100mL 1mol/L NaCl溶液,下列操作中错误的是
A.在托盘天平上放两片大小一样的纸,然后将氯化钠放在纸片上称量
B.把称得的氯化钠放入盛有适量蒸馏水的烧杯中,溶解、冷却,再把溶液移入容量瓶中
C.用蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液也移入容量瓶中
D.沿玻璃棒往容量瓶中加入蒸馏水,直至溶液凹液面恰好与刻度线相切
难度: 中等查看答案及解析
-
下列各组给定原子序数的元素,不能形成原子数之比为1:1的稳定化合物是
A.3和17 B.1和8 C.1和6 D.7和12
难度: 中等查看答案及解析
-
可溶性化合物A、B、C由下表中离子组合而成(每种离子只存在于一种化合物中)
阳离子
Mg2+、Ag+、Na+
阴离子
、
、
现将等物质的量的A、B、C一起溶于水后,所得混合溶液中除
、
外还含有五离子。则A的化学式不可能是
A、
B、
C、
D、
难度: 中等查看答案及解析
-
某原电池总反应的离子方程式为:2Fe3++Fe=3Fe2+,不能实现该反应的原电池是
A.正极为Cu,负极为Fe,电解质为FeCl3溶液
B.正极为C,负极为Fe,电解质为Fe(NO3)3溶液
C.正极为Fe,负极为Zn,电解质为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质为Fe2(SO4)3溶液
难度: 中等查看答案及解析
-
下列离子方程式正确的
A.往碳酸氢钙溶液中滴入少量氢氧化钠溶液:OH-+HCO
Ca2+=CaCO3↓+H2O
B.将一小块金属钠投入到硫酸铜溶液中:2Na+Cu2+====Cu+2Na+
C.NaHCO3溶液显碱性:HCO
+H2O
OH- +CO
D.氯气溶解于水:Cl2+H2O
2H++Cl-+ClO-
难度: 中等查看答案及解析
-
下列溶液中有关物质的量浓度关系和计算不正确的是
A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)<c(NaHCO3)<c(CH3COONa)
B.已知25°C时
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
mol·L-1
C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有
难度: 中等查看答案及解析
-
关于下列图示的说法中正确的是
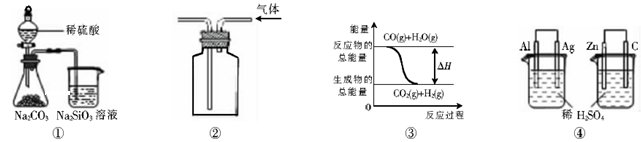
A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图②所示实验装置排空气法收集CO2气体
C.图③表示可逆反应CO(g)+H2O(g)
CO2(g)+H2(g)的△H大于0
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
难度: 中等查看答案及解析
-
某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA-
H++A2-。关于下列四种溶液的说法正确的是
①0.01mol/L的H2A溶液;②0.01mol/L的NaHA溶液;③0.02mol/L的HCl溶液与0.04mol/L的NaHA溶液等体积混合;④0.02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合;
A.四种溶液中c(HA-)浓度大小:③>②>①>④
B.溶液①中一定不存在OH-
C.溶液②中存在水解平衡:HA-+H2O
H2A+OH-
D.溶液③中有关离子浓度关系:c(HA-)+c(A2-)=c(Na+)
难度: 中等查看答案及解析
-
在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+ B(?)
xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是。
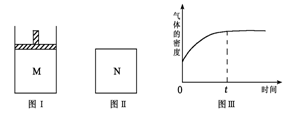
A.x =4
B.若N中气体的密度如图Ⅲ所示,则A、B都是气态
C.若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
难度: 中等查看答案及解析
-
有一无色溶液,可能含有K+、A13+、Mg2+、NH4+、Cl—、SO42—、HCO3—、MnO4—中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的
A.肯定有A13+、Mg2+、NH4+、Cl— B.肯定有Al3+、Mg2+、HCO3—
C.肯定有K+、HCO3—、MnO4— D.肯定有A13+、Mg2+、SO42—
难度: 中等查看答案及解析
-
往一体积不变的密闭容器中充入H2和I2,发生反应H2(g) + I2(g)
2HI(g);
,当达到平衡后,t0 时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大(如图所示),下列说法正确的是
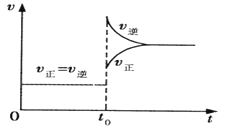
A.容器内气体颜色变深,平均相对分子质量不变
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度减小
D.t0 时减小体积或升高体系温度
难度: 中等查看答案及解析
-
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是

A.甲、乙两烧杯中溶液的pH均升高
B.当b极增重5.4g时,d极产生的气体为2.24L(标准状况)
C.当电解一段时间后,将甲、乙两溶液混合,一定会生成沉淀
D.乙烧杯中c的电极反应式为2Cl--2e-=Cl2↑
难度: 中等查看答案及解析