-
设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
A. 30 g乙烷中所含的极性共价键数为7NA
B. 标准状况下,22.4 L N2和CO2混合气体所含的分子数为2NA
C. 1 L浓度为1 mol·L-1的 H2O2水溶液中含有的氧原子数为2NA
D. MnO2和浓盐酸反应生成1 mol氯气时,转移的电子数为2NA
难度: 简单查看答案及解析
-
EDTA 是一种重要的络合剂。4mol一氯乙酸和1mol乙二胺(
)在一定条件下发生反应生成1molEDTA和4molHCl,则EDTA的分子式为( )
A. C10H16N2O8 B. C10H20N2O8 C. C8H16N2O8 D. Cl6H20N2O8Cl
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. Fe(OH)3溶于HI溶液中: Fe(OH)3+3H+=Fe3++3H2O
B. 磁性氧化铁溶于稀盐酸: Fe3O4+8H+=Fe3++2Fe2++4H2O
C. NaAlO2溶液中通入过量CO2 :AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
D. NH4HCO3溶液与足量Ba(OH)2溶液混合: HCO3-+Ba2++OH-+BaCO3↓+H2O
难度: 简单查看答案及解析
-
下列实验操作与预期目的或所得结论一致的是
A. 用铂丝蘸取某溶液进行焰色反应,火焰星黄色,证明该溶液中一定不含有K+
B. 向浓度均为0.1mol/L的NaCl和NaI混合溶液中滴加少量AgNO3溶液,出现黄色沉淀,说明Ksp(AgCl)>Ksp(AgI)
C. 向某溶液中加入硝酸酸化的BaCl溶液,出现白色沉淀,说明该溶液中一定含有SO42-
D. 在乙酸、乙醇与乙酸乙酯的混合物中加入适量饱和烧碱溶液充分混合后分液,可得到较纯净的乙酸乙酯
难度: 简单查看答案及解析
-
下列各组离子一定能大量共存的是
A. 某无色透明的酸性溶液:Cl-、Na+、MnO4-、SO42-
B. 能使pH试纸变深蓝色的溶液:Na+、NH4+、K+、CO32-
C. 加入过量NaOH溶液后可得到澄清的溶液:K+、Ba2+、HCO3-、Cl-
D. 0.1mol/LAlO2-溶液中:Na+、K+、SO32-、CO32-
难度: 中等查看答案及解析
-
乌头酸的结构简式如图所示,下列关于乌头酸的说法错误的是( )

A. 化学式为C6H6O6
B. 乌头酸能发生水解反应和加成反应
C. 乌头酸能使酸性高锰酸钾溶液褪色
D. 含l mol乌头酸的溶液最多可消耗3 mol NaOH
难度: 中等查看答案及解析
-
一种以NaBH4和H2O2为原料的新型电池的工作原理如图所示。下列说法错误的是
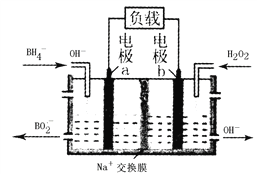
A. 电池的正极反应为H2O2+2e-==2OH-
B. 电池放电时Na+从a极区移向b极区
C. 电子从电极b经外电路流向电极a
D. b极室的输出液经处理后可输入a极室循环利用
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期元素,且X、Z原子序数之和是Y、W原子序数之和的1/2。甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元索对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是

A. 原于半径:r(Y)>r(Z)>r(W)
B. 化合物N、乙烯使溴水褪色的原理相同
C. 含W元素的盐溶液可能显酸性、中性或碱性
D. Z与X、Y、W形成的化合物中,各元素均满足8电子结构
难度: 困难查看答案及解析
-
25℃时,向100 mL 0.1 mol•L-1 NH4HSO4溶液中滴加0.1 mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸)。下列说法错误的是( )
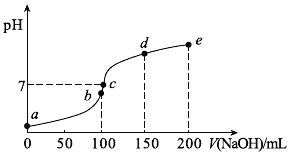
A. a点时溶液的pH<1
B. c点时离子浓度大小顺序为:c(Na+)>c(SO42-)>c(NH4+)
C. de段上的点均满足关系式:c(NH4+)+c(Na+)>2c(SO42-)
D. a点到b点的过程中,溶液的导电能力增强
难度: 困难查看答案及解析
-
在某2 L恒容密闭容器中充入2 mol X(g)和1 mol Y(g)发生反应:2X(g)+Y(g)
3Z(g),反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
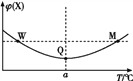
A. M点时,Y的转化率最大
B. 升高温度,平衡常数减小
C. 平衡后充入Z,达到新平衡时Z的体积分数增大
D. W、M两点Y的正反应速率相同
难度: 困难查看答案及解析
-
某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS,某同学以该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:
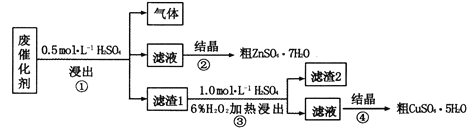
已知:1.步骤①中发生的化学反应为非氧化还原反应 2.滤渣2的主要成分是SiO2和S,下列说法不正确的是
A. 步骤①,最好在通风橱中进行
B. 步骤①和③,说明CuS不溶于稀硫酸而ZnS溶于稀硫酸
C. 步骤③,涉及的离子反应为CuS+H2O2+2H+
Cu2++S+2H2O
D. 步骤②和④,均采用蒸发结晶的方式获取溶质
难度: 中等查看答案及解析
-
现有a mol/L 的NaX和b mol/L的NaY两种盐溶液。下列说法正确的是
A. 若a=b且c(X-)= c(Y-)+ c(HY),则HX为强酸
B. 若a=b且pH(NaX)>pH(NaY),则c(X-)+ c(OH-)> c(Y-)+ c(OH-)
C. 若a>b且c(X-)= c(Y-),则酸性HX>HY
D. 若两溶液等体积混合,则c(Na+)="(a+b)" mol/L(忽略混合过程中的体积变化)
难度: 困难查看答案及解析
-
将17.9g由Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生气体3.36L(标准状况);另取等质量的合金溶于过量的稀硝酸中,向反应后的溶液中加入过量的NaOH溶液,得到沉淀的质量为25.4g;若HNO3的还原产物仅为NO,则生成NO的标准状况下的体积为
A.2.24L B.4.48L C.6.72L D.8.96L
难度: 困难查看答案及解析
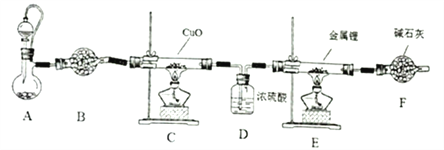



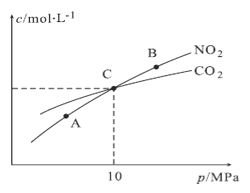

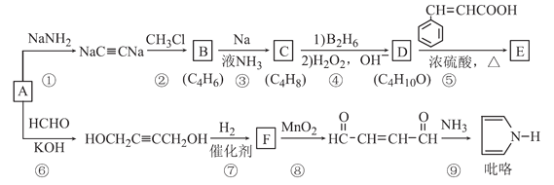
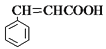 )的同分异构体中,含有苯环和碳碳双键,且能够发生水解反应的共有_____种(不考虑顺反异构)。与D互为同分异构体,且核磁共振氢谱有面积比为2:3的两组峰的有机物的结构简式是___________。
)的同分异构体中,含有苯环和碳碳双键,且能够发生水解反应的共有_____种(不考虑顺反异构)。与D互为同分异构体,且核磁共振氢谱有面积比为2:3的两组峰的有机物的结构简式是___________。