-
生活是化学的源泉,下列有关生产、生活中的化学叙述不正确的是( )
A.铁强化酱油可通过膳食补充人体所需的铁元素
B.变质的植物油有难闻的气味,是因为植物油发生了酯化反应
C.一定浓度的双氧水可用于伤口的消毒
D.采煤工业上,爆破时把干冰和炸药放在一起,既能增强爆炸威力,又能防止火灾
难度: 简单查看答案及解析
-
分类是学习和研究化学的一种常用的科学方法。下列分类合理的是( )
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③同位素:1H、2H、3H;干冰、液氯都是非电解质
④电解质:明矾、冰醋酸、纯碱;同素异形体:C60、金刚石、石墨
⑤根据分散系的稳定性大小将混合物分为胶体、溶液和浊液
A.只有②④ B.只有②③⑤ C.只有①②④ D.只有②③⑤
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.煤的干馏、石油的分馏都只发生了物理变化
B.棉、麻、丝、毛完全燃烧都只生成CO2和H2O
C.甲烷和苯都能发生取代反应
D.乙醇和乙酸互为同分异构体
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法中正确的有( )
A.lmol Na2O2晶体中共含有4NA个离子
B.0.1mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒
C.常温常压下16gO2和O3混合气体含有NA个氧原子
D.1mol?L-1的CaCl2溶液中含Cl-的数目为2NA;
难度: 困难查看答案及解析
-
下列各组离子一定能大量共存的是( )
A.含有大量Fe3+的溶液中:NH4+、Na+、I-、SCN-
B.在强碱溶液中:Na+、K+、AlO2-、CO32-
C.由水电离的c(H+)=1×10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
难度: 困难查看答案及解析
-
有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B为正极。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。则它们的活动性由强到弱的顺序是( )
A.B>A>D>C B.D>A>B>C C.D>B>A>C D.D>C>A>B
难度: 中等查看答案及解析
-
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M; 关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3;②还原性:Cl->As;③每生成1molAs,反应中转移电子的物质的量为3mol;④ M为OH-;⑤ SnCl62-是氧化产物。
A.①③⑤ B.①②④⑤ C.①②③④ D.只有①③
难度: 中等查看答案及解析
-
下列实验设计及其对应的离子方程式均正确的是( )
A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+="===" Cu2+ + 2Fe2+
B.Na2O2与H2O反应制备O2:Na2O2 + H2O==== 2Na+ + 2OH-+ O2↑
C.向NaAlO2溶液中通入过量CO2:
D.NaHCO3的水【解析】
HCO3-+H2OH3O++CO32-
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.甲烷的标准燃烧热为ΔH=-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1
B.已知H2O(L)=H2O(g) ΔH=+44kJ·mol-1,则2g H2(g)完全燃烧生成液态水比生成
气态水多释放22kJ的能量
C.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH<0
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的ΔH相同
难度: 困难查看答案及解析
-
人民网报道:巴勒斯坦已故领导人阿拉法特遗物检出超过正常标准的放射性
.下列有关叙述正确的是( )
A.Po的相对原子质量为210 B.
与
互为同素异形体
C.Po位于第6周期Ⅵ A族 D.
原子核内的中子数为84
难度: 中等查看答案及解析
-
下列除去杂质的方法正确的是( )
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤,分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛饱和碳酸氢钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
A.①② B.②④ C.③④ D.②③
难度: 中等查看答案及解析
-
已知某可逆反应:mA(g)+nB(g)
xC(g),在密闭容器中进行,下图表示反应在不同时间t、温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则正确的是( )
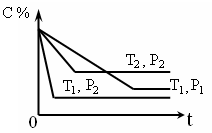
A.T1>T2 ,P1>P2 ,m+n>x,正反应放热
B.T1<T2 ,P1<P2 ,m+n<x,正反应吸热
C.T1>T2 ,P1<P2 ,m+n<x,正反应放热
D.T1<T2 ,P1>P2 ,m+n>x,正反应吸热
难度: 中等查看答案及解析
-
下列溶液中有关物质的量浓度关系正确的是( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+) ="=" c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(Na+)>c(CH3COO-)>c(H+) >c(OH-)
D.0.1mol·L-1的NaHA溶液,其pH=4: c(H2A)>c(A2-)
难度: 极难查看答案及解析
-
分子式为C4H9Cl的同分异构体共有( )
A.2种 B.3种 C.4种 D.5种
难度: 中等查看答案及解析
-
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,其氢氧化物能溶于强碱溶液但不溶于氨水,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是( )
A.原子半径按X、Y、Z、R、W的顺序依次增大
B.WY2能与碱反应,但不能与任何酸反应
C.Z与Y形成的化合物可作为耐高温材料
D.热稳定性:X2R >X2Y
难度: 困难查看答案及解析
-
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
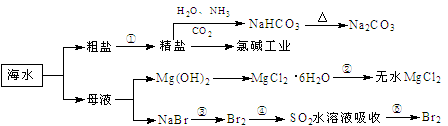
下列有关说法正确的是( )
A.制取NaHCO3的反应是利用其溶解度最小
B.用澄清的石灰水可鉴别NaHCO3和Na2CO3
C.在第③、④、⑤步骤中,溴元素均被氧化
D.工业上通过电解饱和MgCl2溶液制取金属镁
难度: 中等查看答案及解析
-
下列示意图与对应的反应情况正确的是( )
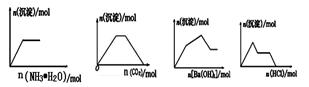
A B C D
A.向AgNO3和CuCl2的混合溶液中缓慢通入氨水溶液
B.向NaOH和Ca(OH)2的混合溶液中通入CO2
C.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
D.NaAlO2溶液中逐滴加入盐酸
难度: 困难查看答案及解析
-
下列实验操作正确且能达到预期目的的是( )
实验目的
操 作
①
比较水和乙醇中羟基氢的活泼性强弱
用金属钠分别与水和乙醇反应
②
欲证明溶液中含有SO42-
滴入盐酸酸化的硝酸钡溶液
③
证明SO2具有漂白性
将SO2通入酸性KMnO4溶液中
④
比较确定铜和镁的金属活动性强弱
用Pt作电极电解Mg(NO3)2、Cu( NO3)2混合液
⑤
确定碳和硅两元素非金属性强弱
测同温同浓度Na2CO3和Na2SiO3水溶液的PH
A.①⑤ B.②③⑤ C.①④⑤ D.①②③④⑤
难度: 中等查看答案及解析
-
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法错误的是 ( )
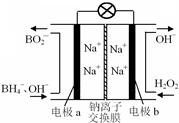
A.电池放电时Na+从a极区移向b极区
B.电极b采用MnO2,MnO2既作电极材料又有催化作用
C.该电池的负极反应为:BH4-+8OH--8e-=BO2-+6H2O
D.每消耗3 mol H2O2,转移的电子为3 mol
难度: 困难查看答案及解析
-
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是 ( )
A.溶液中导电粒子的数目减少
B.溶液中醋酸的电离平衡常数保持不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10mlpH=11的NaOH溶液,混合液pH=7
难度: 中等查看答案及解析
-
将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol ,这些气体恰好能被500mL 2mol/L NaOH溶液完全吸收,发生的反应为:
2NO2+2NaOH=NaNO2+NaNO3+H2O;NO+NO2+2NaOH=2NaNO2+H2O。则生成的盐溶液中NaNO2的物质的量为( )
A.0.4mol B.0.6mol C.0.8mol D.0.2mol
难度: 中等查看答案及解析
-
下列各组物质按右图所示转化关系每一步都能一步实现的是( )

难度: 困难查看答案及解析
-
下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是( )
化学式
AgCl
Ag2CrO4
CH3COOH
HClO
H2CO3
KSP或Ka
KSP=1.8×10-10
KSP=2.0×10-12
Ka=1.8×10-5
Ka=3.0×10-8
Ka1=4.1×10-7
Ka2=5.6×10-11
A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是
c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.碳酸钠溶液中滴加少量氯水的离子方程式为CO32-+Cl2=HCO3-+Cl-+HClO
C.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5
D.向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3溶液,CrO42-先形成沉淀
难度: 困难查看答案及解析
-
Na2O2、HCl、Al2O3三种物质溶于水中,完全反应后,测得所得溶液中只含有AlO2-、Na+、Cl-(不考虑AlO2-的水解),则Na2O2、HCl、Al2O3的物质的之比( )
A.4:6:1 B.8:6:1 C.3:3:1 D.2:2:2
难度: 中等查看答案及解析

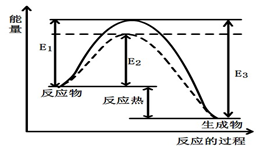
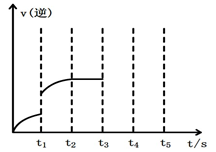



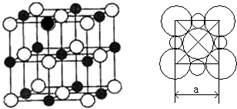 若
若