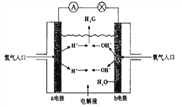
-
化学家借助太阳能产生的电能和热能,用空气和水作原料成功地合成了氨气。下列有关说法正确的是
A. 该合成中所有的电能和热能全部转化为化学能
B. 该合成氨过程不属于氮的固定
C. 空气、水、太阳能均为可再生资源
D. 断裂N2中的N≡N键会释放出能量
难度: 中等查看答案及解析
-
下列因素中,对发生在溶液中且无气体参加的反应的速率不产生显著影响的是
A. 压强 B. 温度 C. 浓度 D. 反应物的性质
难度: 简单查看答案及解析
-
100mL浓度为2mol·L-1的盐酸溶液跟过量的锌片反应,为减慢反应速率,又不影响生成H2的总量,可采用的方法有
A.加适量6mol·L-1HCl溶液
B.加数滴CuCl2溶液
C.加适量醋酸钠固体
D.加适量NaNO3溶液
难度: 简单查看答案及解析
-
下列叙述中正确的是
A. 溶度积大的化合物溶解度一定大
B. AgCl水溶液的导电性很弱,所以AgCl是弱电解质
C. 将难溶电解质放入纯水中,溶解达平衡时,电解质离子浓度的乘积就是该物质的溶度积
D. 在一定温度下,向含有AgCl固体的溶液中加入适量的水使AgCl溶解,又达到平衡时,AgCl的溶解度不变,溶度积也不变
难度: 简单查看答案及解析
-
下列电离方程式正确的是
A. KH2PO4溶于水:H2PO4-
2H++PO43-
B. NaHS溶于水:NaHS===Na++HS-,HS-
H++S2-
C. HF溶于水:HF===H++F-
D. NH4Cl溶于水:NH4++H2O
NH3·H2O+H+
难度: 简单查看答案及解析
-
某一化学反应,反应物和生成物都是气体,改变下列条件一定能使化学平衡向正反应方向移动的是( )
A.增大反应物浓度 B.减小反应容器的体积
C.增大生成物浓度 D.升高反应温度
难度: 中等查看答案及解析
-
25℃时,向VmL pH=a的醋酸中滴加pH=b的NaOH溶液VmL时,两者恰好完全反应,下列说法正确的是
A. 反应前醋酸和NaOH对水的电离影响程度一样
B. 反应后溶液呈中性
C. 反应后溶液中由水电离的c(H+)小于10-7mol/L
D. 此时a+b的值是大于14
难度: 简单查看答案及解析
-
在CH3COOH溶液中存在如下平衡:CH3COOH
H+ + CH3COO- 。加入少量的下列固体物质,能使平衡逆向移动的是
A. NaCl B. CH3COONa C. Na2CO3 D. NaOH
难度: 简单查看答案及解析
-
某次酸雨的分析数据如下:c(NH4+)=2.0×10-5mol/L,c(Cl-)=6.0×10-5mol/L,c(Na+)=1.9×10-5mol/L,c(NO3-)=2.3×10-5mol/L,c(SO42-)=2.8×10-5mol/L,则此次酸雨的pH大约为( )
A. 3 B. 4 C. 5 D. 6
难度: 中等查看答案及解析
-
在Al3+ + 3H2O
Al(OH)3 + 3H+的平衡体系中,要抑制Al3+的水解,可采取的措施为
A. 加热 B. 通入氯化氢气体
C. 加入适量的氢氧化钠溶液 D. 加入固体AlCl3
难度: 简单查看答案及解析
-
向氯化铁溶液中加入过量氢氧化钠溶液,震荡后静置一段时间。下列关于该体系的说法中,不正确的是
A. 生成了氢氧化铁沉淀
B. 溶液中存在有Fe3+
C. 加入少量盐酸,则溶液中Fe3+浓度会减小
D. 体系中存在着氢氧化铁的沉淀溶解平衡
难度: 简单查看答案及解析
-
在0.1mol·L-1氨水中加入少量的氯化铵晶体,则溶液的pH
A. 变小 B. 变大 C. 不变 D. 无法确定
难度: 简单查看答案及解析
-
为了配制NH4+浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入:①适量HCl②适量NaCl③适量的氨水④适量的NaOH,正确的是
A. ①② B. ④ C. ③④ D. ③
难度: 简单查看答案及解析
-
水的电离过程为H2O
H++OH-,在25℃、35℃时其离子积分别为K(25℃)=1.0×10-14、K(35℃)=2.1×10-14,则下列说法中正确的是
A. 在35℃时,纯水中c(H+)>c(OH-) B. c(H+)随着温度的升高而降低
C. 水的电离过程是吸热过程 D. 水的电离度α(25℃)>α(35℃)
难度: 简单查看答案及解析
-
在一定条件下,有下列气体分子数相同的可逆反应,其平衡常数K值分别如下:
①H2+F2=2HF K=1047 ②H2+Cl2=2HCl K=1017
③H2+Br2=2HBr K=109 ④H2+I2=2HI K=1
试判断平衡时各反应的正反应进行的程度由大到小的顺序是
A. ①②③④ B. ④②③① C. ①④③② D. 无法确定
难度: 简单查看答案及解析
-
如图曲线a和b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是( )
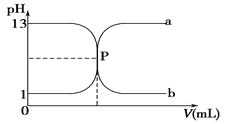
A. 盐酸的物质的量浓度为1 mol·L-1
B. P点时恰好完全中和,溶液呈中性
C. 曲线a是盐酸滴定氢氧化钠溶液的滴定曲线
D. 酚酞不能用作本实验的指示剂
难度: 困难查看答案及解析