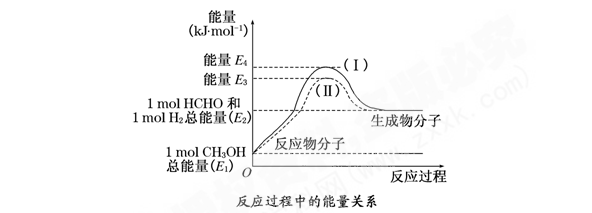
-
氢气是人类最理想的能源。已知在25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则下列热化学方程式书写正确的是:
A.2H2 + O2=2H2O △H= –142.9 kJ/mol
B.2H2(g) + O2(g)=2H2O(l) △H= – 142.9 kJ/mol
C.2H2(g) + O2(g)=2H2O(l) △H= – 571.6 kJ/mol
D.2H2(g) + O2(g)=2H2O(l) △H = + 571.6 kJ/mol
难度: 简单查看答案及解析
-
在一定条件下,在体积为VL的密闭容器中发生反应:mA + nB pC。t秒末,A减少了1 mol,B减少了1.25 mol,C增加了0.5 mol。则m ∶ n ∶ p应为
A.4∶ 5∶ 2 B.2∶ 5∶ 4 C.1∶ 3∶ 2 D.3∶ 2∶ 1
难度: 简单查看答案及解析
-
下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解 B.乙醇燃烧
C.铝热反应 D.氧化钙溶于水
难度: 简单查看答案及解析
-
对于反应 2A(g)+ B(g)
2C(g)△H > 0 。下列反应条件都有利于生成C的是
A.低温、低压 B.高温、高压 C.低温、高压 D.高温、低压
难度: 简单查看答案及解析
-
已知H2(g)+Cl2(g)=2HCl(g) △H= -184.6kJ·mol-1,反应HCl(g)=H2(g)+Cl2(g)的△H为
A.+184.6kJ·mol-1 B.―92.3kJ·mol-1 C.―369.2kJ·mol-1 D. +92.3kJ·mol-1
难度: 简单查看答案及解析
-
可逆反应N2+3H2
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
A.3υ正(N2)=υ正(H2) B.υ正(N2)=υ逆(NH3)
C.2υ正(H2)=3υ逆(NH3) D.υ正(N2)=3υ逆(H2)
难度: 简单查看答案及解析
-
氢气在氧气中燃烧产生蓝色火焰。已知破坏1molH-H键消耗的能量为Q1kJ,破坏1molO = O键消耗的能量为Q2kJ,形成1molH-O键释放的能量为Q3kJ。则下列关系式中正确的是
A.2Q1+ Q2 > 4Q3 B.2Q1+Q2<4Q3
C.Q1 +Q2 <Q3 D.Q1+Q2=Q3
难度: 简单查看答案及解析
-
对于一个密闭容器中进行的可逆反应:mA(g) + nB(g)
eC(g )+dD (g) △H<0下列能证明该反应一定达到平衡状态的是
A.容器内压强不随时间的延长而变化
B.单位时间内每生成e个C分子的同时也生成了n个B分子
C.单位时间内每消耗m个A分子的同时也生成了d个D分子
D.A、B、C、D四种物质的分子数之比为m∶n∶e ∶d
难度: 简单查看答案及解析
-
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol
890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是
A.C(s)+O2(g)=CO(g) △H= ―393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(l) △H= +571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= ―890.3 kJ/mol
D.C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H= ―2800 kJ/mol
难度: 简单查看答案及解析
-
在下列平衡2CrO42-(黄色)+ 2H+
Cr2O72-(橙红色)+ H2O中,溶液介于黄和橙红色之间,今欲使溶液的橙红色变深,则要在溶液中加入
A.H+ B.OH- C.K+ D.H2O
难度: 简单查看答案及解析
-
下列关于热化学反应的描述中正确的是:
A.HCl与NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热
△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热△H=+566.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 简单查看答案及解析
-
下列各条件下发生反应X + Y = XY时,速率最快的是
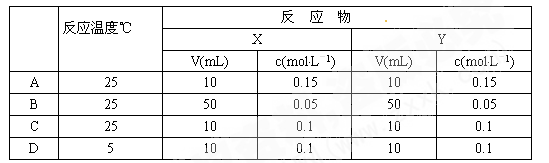
难度: 简单查看答案及解析
-
把 0.6molX气体和0.4molY气体混合于2L的密闭容器中,使它们发生如下反应 :
3X(g)+ Y(g)
nZ(g)+ 2W(g),5min末已生成 0.2molW ,若测知以 Z 表示的平均反应速率为 0. 01mol·L-1·min-1,则 n是
A.1 B.2 C.3 D.4
难度: 简单查看答案及解析
-
已知:(1)Zn(s)+1/2O2(g)=ZnO(s) △H=-348.3kJ·mol-1 ,
(2)2Ag(s)+1/2O2(g)=Ag2O(s) △H=-31.0kJ·mol-1,
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于
A.-317.3kJ·mol-1 B.-379.3kJ·mol-1 C.-332.8kJ·mol-1 D.+317.3kJ·mol-1
难度: 简单查看答案及解析
-
已知:4NH3(g)+5O2(g)
4NO(g)+6H2O(g) △H=-1025kJ/mol该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
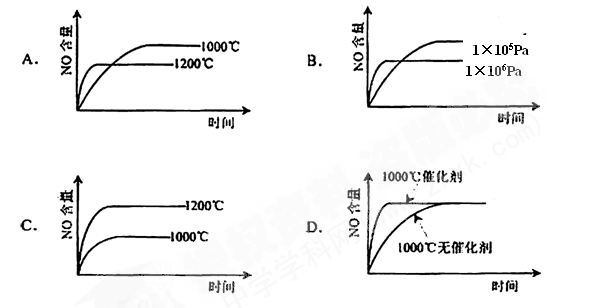
难度: 简单查看答案及解析
-
已知热化学方程式2H2(g)+O2(g)=2H2O(l) △H1<0;2H2O(g)=2H2(g)+O2(g) △H2。下列说法正确的是
A.方程式中化学计量数表示分子数 B.△H2>0
C.△H2=-△H1 D.利用△H1、△H2可求出水的气化热
难度: 简单查看答案及解析
-
已知反应A2(g)+2B2(g)
2AB2(g) △H<0,下列说法正确的是:
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,降低温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
难度: 简单查看答案及解析
-
以NA代表阿伏加德罗常数,则关于热化学方程式 C2H2 ( g ) +5/2O2 ( g ) = 2CO2 ( g )+H2O ( l ) △H = —1300kJ / mol 的说法中,正确的是
A. 当10 NA个电子转移时,该反应放出1300kJ的能量
B. 当1 NA个水分子生成且为液体时,吸收1300kJ的能量
C. 当2 NA个碳氧共用电子对生成时,放出1300kJ的能量
D. 当8 NA个碳氧共用电子对生成时,放出1300kJ的能量
难度: 简单查看答案及解析
-
在一可变容积的密闭容器中进行反应:C(s) + H2O(g)
CO(g) + H2(g),下列条件的改变对反应速率几乎无影响的是
A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变,充入N2,使体系的压强增大
D.保持压强不变,充入N2,使容器的体积变大
难度: 简单查看答案及解析
-
根据热化学方程S ( s ) + O2 ( g ) = SO2 ( g ) △H = -297.23 kJ/mol (反应在25℃,101kPa下发生)分析下列说法正确的是
A.根据热化学方程式,燃烧1mol S放出的热量为297.23 kJ
B.形成1 mol SO2 的化学键所释放的总能量大于断裂 1 mol S ( s )和 1mol O2 ( g )的化学键所吸收的总能量
C.S ( g ) + O2 ( g ) = SO2 ( g ) △H =-Q kJ/mol 则Q>297.23
D.S ( g ) + O2 ( g ) = SO2 ( g ) △H =-Q kJ/mol 则Q<297.23
难度: 简单查看答案及解析