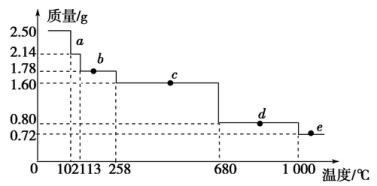
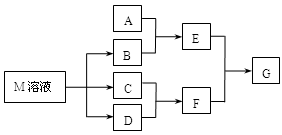
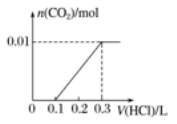
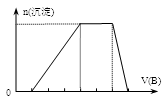
-
化学在生产和生活中有重要的应用。下列说法不正确的是
A.小苏打在生活中可用做发酵粉
B.电解MgCl2溶液可制金属镁
C.可溶性铁盐或铝盐可用于水的净化
D.二氧化硅可用于制作光导纤维
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列说法中正确的是
A.标准状况下,20g D2O分子中所含中子数为10NA
B.1 mol CO2与1 L 2 mol·L-1的NaOH溶液反应后,溶液中CO32-数为NA
C.6.8 g熔融的KHSO4中含有0.1 NA个阳离子
D.2.7 g铝与3.36 L氯气充分反应,转移电子数一定为0.3 NA
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.Na2O2溶于水产生O2:Na2O2+H2O= 2Na++2OH-+O2↑
B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+ =Fe3++3H2O
C.向FeBr2溶液中通入足量Cl2:2Fe2++2Br-+2Cl2===Br2+2Fe3++4Cl-
D.向50 mL 1 mol·L-1明矾溶液中滴入两滴0.1 mol·L-1Ba(OH)2溶液:
2Al3++3SO42-+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
难度: 困难查看答案及解析
-
已知Fe3O4可表示成FeO·Fe2O3,水热法制备Fe3O4纳米颗粒的总反应为: 3Fe2++2S2O32-+O2+4OH-= Fe3O4+S4 O62-+2H2O。下列说法正确的是
A.O2和S2O32-是氧化剂,Fe2+是还原剂
B.每生成1 mol Fe3O4,转移电子的物质的量为2 mol
C.若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol
D.参加反应的氧化剂与还原剂的物质的量之比为1∶1
难度: 中等查看答案及解析
-
下列实验装置不能达到实验目的
的是
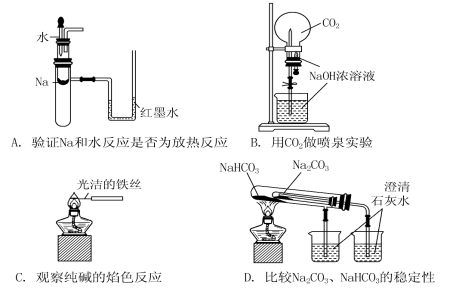
难度: 中等查看答案及解析
-
下列有关物质性质的说法正确的是
A.铝与Fe2O3发生铝热反应后固体物质增重
B.Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到
C.过量的铜与浓硝酸反应可生成NO
D.由于铝元素和铁元素都有+3价,由2Al+6HCl = 2AlCl3+3H2↑;可知:2Fe+6HCl= 2FeCl3+3H2↑
难度: 中等查看答案及解析
-
铁、铜混合粉末18.0g加入到100ml 5.0mol/LFeCl3溶液中,剩余固体质量为3.2g。下列说法正确的是
A.剩余固体是铁、铜混合物
B.反应后溶液中n(Fe2+)+ n(Cu2+)=0.75 mol
C.反应后溶液中n(Fe3+)=0.10 mol
D.原固体混合物中铜的质量是8.0g
难度: 中等查看答案及解析