-
在“绿色化学”工艺中,理想的状态是反应物中的原子全部转化为期望的最终产物,即原子的利用率为100%。下列反应类型中能体现“原子经济性”原则的是( )
①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应 ⑥加聚反应
A.①②⑤ B.②⑤⑥ C.③④ D.只有⑥
难度: 简单查看答案及解析
-
从海带中提取碘单质,成熟的工艺流程如下:
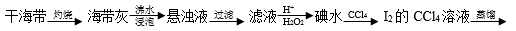
下列关于海水制碘的说法不正确的是
A. 实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌
B. 含I-的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应
C. 在碘水中加入几滴淀粉溶液,溶液变蓝色
D. 碘水加入CCl4得到I2的CCl4溶液,该操作为“萃取”
难度: 简单查看答案及解析
-
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
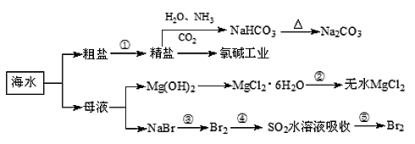
下列有关说法正确的是( )
A.在第③、④、⑤步骤中,溴元素均被氧化
B.制取NaHCO3的反应是利用其在此反应所涉及物质中溶解度最小
C.用澄清的石灰水可鉴别NaHCO3和Na2CO3
D.工业上通过电解饱和MgCl2溶液制取金属镁
难度: 中等查看答案及解析
-
我国三峡工程所提供的清洁、廉价、可再生的水电,相当于每年燃烧 3000 万吨原煤的火力发电厂产生的电能,因此三峡工程有助于控制 ①温室效应 ②SO2的排放 ③白色污染 ④臭氧空洞( )
A.①② B.①②③ C.①②④ D.①②③④
难度: 简单查看答案及解析
-
“绿色化学”的主要内容之一是从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物.下列化学反应不符合“绿色化学”理念的是( )
A.制氯乙烷:CH2=CH2+HCl
CH3CH2Cl
B.制甲基丙烯酸甲酯:CH3C≡CH+CO+CH3OH
CH2=C(CH3)COOCH3
C.制CuSO4:2Cu+O2 = 2CuO,CuO+H2SO4(稀)═CuSO4+H2O
D.制Cu(NO3)2:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
难度: 中等查看答案及解析
-
反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3 mol,则此反应的平均速率v为( )
A.v(O2)=0.01 mol·L-1·s-1 B.v(NO)=0.08 mol·L-1·s-1
C.v(H2O)=0.003 mol·L-1·s-1 D.v(NH3)=0.001 mol·L-1·s-1
难度: 中等查看答案及解析
-
下列说法错误的是( )
①加热HgO制取Hg
②将钠加入氯化铜溶液中制取铜
③电解熔融氯化铝制取铝
④电解饱和食盐水来制取金属钠
⑤不能利用铝热反应制取镁
A.②④ B.①③⑤ C.②③④ D.①⑤
难度: 中等查看答案及解析
-
2015年5月郴州成功举办了第三届中国(湖南)国际矿物宝石博览会。矿博会上展示了色彩缤纷、形状各异的金属矿物,下列金属的冶炼属于热还原法的是( )
A.2NaCl(熔融)=2Na+Cl2↑
B.WO3+3H2
W+3H2O
C.Fe+CuSO4=Cu+FeSO4
D.2Ag2O
4Ag+O2↑
难度: 中等查看答案及解析
-
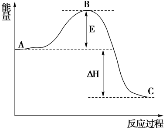
下列与化学反应能量变化相关的叙述正确的是( )
A.反应物总能量低于生成物总能量时,该反应一定不能发生
B.化学键的键能越大,物质的能量越高
C.一个反应的焓变因反应物的用量和反应条件的改变而发生改变
D.应用盖斯定律,可计算某些难以直接测量的反应焓变
难度: 中等查看答案及解析
-
已知一定条件下断裂1 mol下列化学键生成气态原子需要吸收的能量如下:H—H 436 kJ;Cl—Cl 243 kJ;H—Cl 431 kJ。下列所得热化学方程式或结论正确的是( )
A.H(g)+Cl(g)=HCl(g)ΔH=﹣431kJ·mol-1
B.2HCl(g)=H2(g)+Cl2(g)的反应热ΔH<0
C.H
2(g)+Cl2(g)=2HCl(g)ΔH=﹣183kJ
D.相同条件下,H2(g)+Cl2(g)=2HCl(g)反应在光照和点燃条件下的ΔH不相等
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应中和热ΔH=-57.3 kJ·mol-1,H2SO4和Ba(OH)2反应热ΔH=2×(-57.3)kJ·mol-1
B.1 mol甲烷燃烧生成气态水和二氧化碳气体所放出的热量就是甲烷的燃烧热
C.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ·mol-1
D.需要加热才能发生的反应一定是吸热反应
难度: 中等查看答案及解析
-
常温下,1mol化学键分解成气态原子所需要的能量用E表示。根据表中信息判断下列说法不正确的是( )
共价键
H—H
F—F
H—F
H—Cl
H—I
E/(kJ·mol-1)
436
157
568
432
298
A.432kJ·mol-1>E(H—Br)>298kJ·mol-1
B.表中最稳定的共价键是H—F键
C.H2(g)→2H(g)△H=+436kJ·mol-1
D.H2(g)+F2(g)=2HF(g)△H=-25kJ·mol-1
难度: 简单查看答案及解析
-
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为
S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=xkJ•mol-1
已知:碳的燃烧热△H1=akJ•mol-1
S(s)+2K(s)═K2S(s)△H2=bkJ•mol-1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=ckJ•mol-1则x为
A.3a+b-c B.c-3a-b C.a+b-c D.c-a-b
难度: 简单查看答案及解析
-
2 mol A与2 mol B混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g)
2C(g)+zD(g);若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
A.v(C)=v(D)=0.2 mol·L-1·s-1 B.z=3
C.B的转化率为75% D.反应前与2 s后容器的压强比为4∶3
难度: 简单查看答案及解析