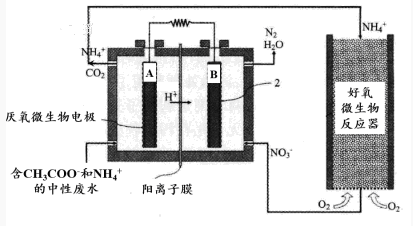
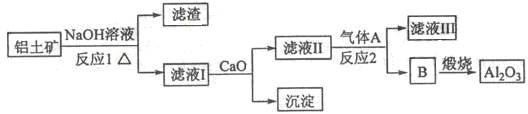
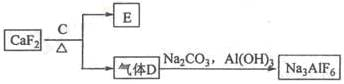
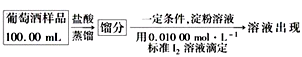
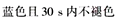-
下列说法正确的是
A. 增加炼铁高炉的高度可以减少尾气CO的排放
B. 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同
C. 白炽灯工作时,电能全部转化为光能
D. 日本福岛核电站核泄漏事故提醒我们不要开发新能源,要大力挖掘化石能源
难度: 简单查看答案及解析
-
在铁与稀硫酸反应制氢气的实验中,下列因素对产生H2速率没有影响的是
A. 加几滴硫酸铜溶液 B. 将铁块换成铁粉
C. 初始加入的稀硫酸由5 mL变成10 mL D. 加氯化钠溶液
难度: 简单查看答案及解析
-
下列物质中均含有酸性杂质,除去这些杂质的方法中正确的是
A. 乙醇中含乙酸杂质:加入足量氧化钙,蒸馏
B. 制氯气时,依次通过饱和NaHCO3溶液和浓硫酸净化气体
C. CO2中混有H2S通过足量的浓硫酸溶液洗气,以得到纯净的CO2
D. 通过灼热的镁粉除去N2中的O2
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法中正确的是( )
A. 由12C、16O、14N组成的44 g CO2和44 gN2O中含有的中子数均为22 NA
B. 15.6 gNa2O2与过量CO2反应时,转移的电子数为0.4 NA
C. 1 mol硫酸氢钠晶体中含有SO42-离子数为NA
D. 标准状况下,22.4 L庚烷的分子数约为NA
难度: 中等查看答案及解析
-
下列各组离子一定能大量共存的是
A. 含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.
的溶液中:Na+、K+、AlO2-、CO32-
C. 在pH=1的溶液中:K+、Al3+、SO42‾、F‾
D. 由水电离的c(H+)=10-14 mol·L-1的溶液中:K+、Na+、Ca2+、HCO3‾
难度: 中等查看答案及解析
-
山梨酸是国际粮农组织和卫生组织推荐的高效安全的防腐保鲜剂,广泛应用于食品、饮料、烟草、农药、化妆品等行业,它是一种无色针状晶体或白色粉末,它的结构简式为CH3—CH=CH—CH=CH—COOH。下列关于山梨酸的叙述不正确的
A. 只要食品中添加的山梨酸符合国家要求,那么该食品可以放心食用
B. 山梨酸能发生加成反应、取代反应、氧化反应
C. 山梨酸的分子式为C6H8O ,可以写出含有苯环的同分异构体
D. 1mol山梨酸能和足量碳酸氢钠溶液反应能生成1 mol二氧化碳气体
难度: 中等查看答案及解析
-
常温下,盐酸与氢氧化钠溶液相互滴定的滴定曲线如下图,下列叙述不正确的是
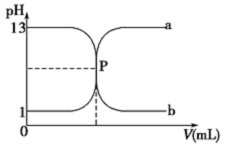
A. 滴定过程的任何时刻都存在:c(H+)+ c(Na+)=c(OH-)+c(Cl-)
B. 曲线b是用氢氧化钠溶液滴定盐酸溶液的滴定曲线
C. 氢氧化钠溶液的物质的量浓度为0.1mol•L-1
D. P点时恰好完全中和,溶液呈中性
难度: 困难查看答案及解析
-
下列常见金属的冶炼原理中不合理的是
金属
冶炼原理
A
Fe
Fe2O3+2Al
2Fe+Al2O3
B
Hg
2HgO
2Hg+O2↑
C
Mg
H2+MgO
Mg+H2O
D
Cu
Cu2S+O2
2Cu+SO2
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
难度: 中等查看答案及解析
-
某氧化物不溶于水,溶于熔化的NaOH中,生成易溶于水的化合物,向稀盐酸中滴加所生成化合物的水溶液,立即有白色沉淀产生,则原氧化物是
A. CuO B. Al2O3 C. N2O5 D. SiO2
难度: 中等查看答案及解析
-
下列说法正确的是
A. 由反应SiO2+4HF =SiF4↑ +2H2O,可知SiO2是碱性氧化物
B. 由酸性溶液中MnO4-可以氧化Cl-,可知酸性溶液中MnO4-也能氧化Br—
C. 由反应CuSO4+H2S =CuS↓+H2SO4,可知酸性H2S>H2S04
D. 由常温下金属钠、铝可溶于NaOH溶液,可知金属镁也能溶于NaOH溶液
难度: 中等查看答案及解析
-
对于铜锌原电池实验后得出的结论和认识中,正确的是
A. 构成原电池正极和负极的材料必须是两种金属
B. 由铜、锌电极与硫酸铜溶液组成的原电池中铜是负极
C. 电子由锌片流经稀硫酸溶液到铜片,氢离子在铜片上得到电子放出氢气
D. 铜锌原电池工作时,若有13g锌被溶解,电路中就有0.4mol电子通过
难度: 中等查看答案及解析
-
将2.7g铝溶解于100mL3mol•L-1NaOH溶液中,然后向所得溶液中加入400mL1mol•L-1的盐酸,最后可得沉淀的质量是( )
A. 2.7g B. 5.2g C. 7.8g D. 10g
难度: 中等查看答案及解析
-
体积为1 mL、浓度均为0.10 mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是
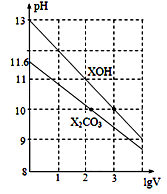
A. XOH是弱碱
B. pH=10的两种溶液中的c(X+):XOH大于X2CO3
C. 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2
D. 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则c(HCO3-)/c(CO32-)减小
难度: 极难查看答案及解析
-
下列实验“操作和现象”与“结论”对应关系正确的是
操作和现象
结论
A
向装有Fe(NO3)2溶液的试管中加入稀H2SO4后,在试管口观察到红棕色气体
HNO3分解生成了NO2
B
向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有砖红色沉淀生成
淀粉没有水解成葡萄糖
C
向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去
使溶液褪色的气体一定是乙烯
D
向水玻璃溶液中通入足量CO2后,产生白色浑浊
生成了硅酸沉淀
难度: 困难查看答案及解析