-
下列说法正确的是
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.自发反应一定是熵增大,非自发反应一定是熵减少或不变
C.自发反应在任何条件下都能实现
D.自发反应在恰当条件下才能实现
难度: 简单查看答案及解析
-
下列说法正确的是
A.热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的数据
B.升高温度或加入催化剂,可以改变化学反应的反应热
C.据能量守恒定律,反应物的总能量一定等于生成物的总能量
D.吸热反应中破坏反应物的全部化学键所需要的能量大于破坏生成物全部化学键所需要的能量
难度: 中等查看答案及解析
-
下列关于化学平衡常数的说法正确的是
A.化学平衡发生移动,平衡常数必发生变化
B.平衡常数发生变化,化学平衡必发生移动
C.改变浓度,平衡常数一定改变
D.催化剂改变达到平衡的时间,必引起平衡常数的改变
难度: 简单查看答案及解析
-
在一定温度下,可逆反应A(g) + 3B(g)
2C(g)达到平衡的标志是
A.A的生成速率与C的分解速率相等;
B.单位时间内生成n mol A,同时生成3n mol B;
C.A、B、C的浓度不再变化;
D.A、B、C的浓度之比为1:3:2
难度: 中等查看答案及解析
-
下列关于强、弱电解质的叙述中,错误的是
A.强电解质在溶液中完全电离,不存在电离平衡
B.在溶液里导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质
C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不同
D.纯的强电解质在液态时,有的导电,有的不导电
难度: 中等查看答案及解析
-
能说明醋酸是弱电解质的事实是
A.醋酸溶液的导电性比盐酸弱
B.醋酸溶液与碳酸钙反应,缓慢放出二氧化碳
C.醋酸溶液用水稀释后,氢离子浓度下降
D.0.1mol/L的CH3COOH溶液中,氢离子的浓度约为0.001mol/L
难度: 简单查看答案及解析
-
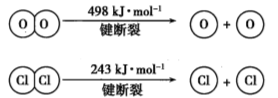
下列说法或表示方法正确的是
A.若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.已知:
,则金刚石比石墨稳定
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH=-285.8kJ/mol
D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,若将含1molCH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3kJ
难度: 中等查看答案及解析
-
在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应,平衡后测得X,Y的转化率与起始时两物质的物质的量之比
的关系如图所示,则X,Y的反应方程式可表示为
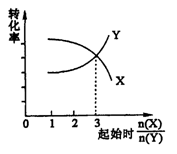
A.2X+Y
3Z
B.3X+2Y
2Z
C.X+3Y
Z
D.3X+Y
Z
难度: 中等查看答案及解析
-
合成氨反应的正反应是气体体积减小的放热反应。合成氨工业的生产流程如下:
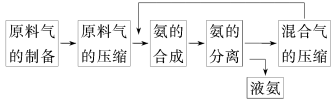
关于合成氨工业的说法中不正确的是
A.混合气进行循环利用遵循绿色化学思想
B.合成氨反应须在低温下进行
C.对原料气进行压缩是为了增大原料气的转化率
D.使用催化剂可以提高反应的速率,但是不能使平衡向正反应方向移动
难度: 中等查看答案及解析
-
密闭容器中有如下反应:mA(g)+nB(g)
pC(g)达到平衡后,保持温度不变,将容器体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.8倍。下列说法中正确的是
A.m+n>p B.A的转化率降低
C.平衡向正反应方向移动 D.C的质量分数增加
难度: 中等查看答案及解析
-
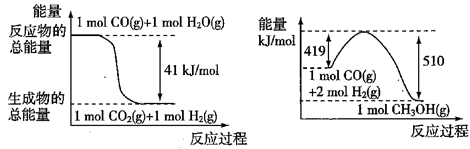
工业制氢气的一个重要反应是:
 已知在25℃时:
已知在25℃时: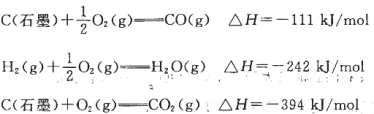
则2 5℃时1 mol CO与水蒸气作用转化为氢气和二氧化碳反应△H为
A.+41.kJ/mol B.-41kJ/mol C.283kJ/mol D.-131kJ/mol
难度: 中等查看答案及解析
-
依据下表判断CH3CH3
CH2=CH2+H2的反应热为
化学键
C-H
C=C
C-C
H-H
键能(kJ·mol-1)
414.4
615.3
347.4
435.3
A.125.6kJ·mol-1 B.-125.6kJ·mol-1
C.46.1kJ·mol-1 D.-46.1kJ·mol-1
难度: 中等查看答案及解析
-
对可逆反应2A(s)+3B(g)
C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v (正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①② B.④ C.③ D.④⑤
难度: 困难查看答案及解析
-
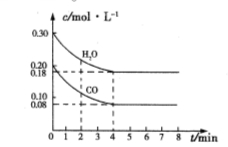
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是
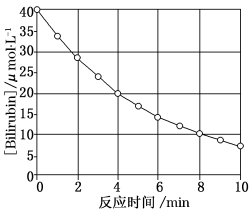
A.2.5 μmol·L-1·min-1和2.0 μmol·L-1
B.2.5 μmol·L-1·min-1和2.5 μmol·L-1
C.3.0 μmol·L-1·min-1和3.0 μmol·L-1
D.5.0 μmol·L-1·min-1和3.0 μmol·L-1
难度: 困难查看答案及解析
-
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)
I3-(aq)。某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
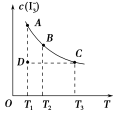
A.反应I2(aq)+I-(aq)
I3-(aq)的ΔH>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,一定有v正<v逆
D.状态A与状态B相比,状态A的c(I2)大
难度: 困难查看答案及解析
-
一定条件下用甲烷可以消除氮氧化物(NOx)的污染。已知:
①CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g);ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g);ΔH=-1160 kJ·mol-1
下列正确的选项是
A.CH4(g)+2NO2(g)==N2(g)+CO2(g)+2H2O(l);ΔH=-867 kJ·mol-1
B.CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子总数为3.2 mol
C.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ
D.若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为3.2 mol.
难度: 困难查看答案及解析
-
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)
Si(s)+4HCl(g)
△H=+QKJ·mol-1,已知Q>0,某温度压强下,将一定量的反应物通入密闭容器中进行以上的反应,下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QKJ
C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率0.03mol/(L·min)
D.当反应吸收热量为0.025QKJ时,生成的HCl通入100mL 1mol·L-1的NaOH恰好反应
难度: 中等查看答案及解析
-
在10L密闭容器中,A、B、C三种气体构成可逆反应体系,某温度下,A、B、C三者物质的量与时间的关系如图甲所示,而C的百分含量与温度的关系如图乙所示。下列说法错误的是
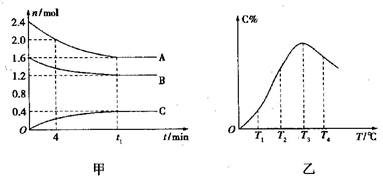
A.0-4min时,A的平均的反应速率为0.01mol·L-1·min-1
B.由T1向T2变化时,
C.此反应的正反应为吸热反应
D.其它条件不变时给平衡体系加压,达新平衡时,C的体积分数增大
难度: 困难查看答案及解析
-
有可逆反应mA(s)+nB(g)
pC(g)+qD(g),反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图所示,根据图中曲线分析,判断下列叙述中,正确的是
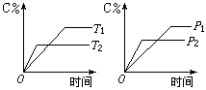
A.到达平衡后,若使用催化剂,C的质量分数增大
B.平衡后,若升高温度,平衡则向逆反应方向移动
C.平衡后增大A的量,有利于提高A的转化率
D.化学方程式中一定是m+n<p+q
难度: 中等查看答案及解析
-
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应:H2(g)+Br2(g)
2HBr(g)
平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是
A.a>b B.a=b C.a<b D.无法确定
难度: 中等查看答案及解析
-
在一定温度下,一定体积的的密闭容器中有如下平衡:H2(气)+I2(气)
2HI(气)。已知H2和I2的起始浓度均为0.10 mol·L-1,达到平衡时HI的浓度为0.16 mol·L-1。若H2和I2的起始浓度均变为0.20 mol·L-1,则平衡时H2的浓度(mol·L-1)是
A.0.16 B.0.32 C.0.04 D.0.02
难度: 中等查看答案及解析
-
已知H2CO3
H++
,
;
,
;
,
。根据上述电离常数分析,下列各式中错误的是
A.
B.
C.
D.
难度: 中等查看答案及解析