-
下列说法中,错误的是
A.蛋白质、淀粉、纤维素水解的最终产物都是纯净物
B.误服重金属盐,立即服用牛奶或豆浆可解毒
C.油脂、乙酸乙酯都属于酯类,但不是同系物
D.苯和乙烯都能发生加成反应
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的数值,下列说法正确的是
A.标准状况下22.4 L Cl2与足量NaOH溶液反应生成NaCl和NaClO,转移电子数为NA
B.电解精炼铜时转移了6.02×1023个电子,阳极溶解32 g铜
C.一定量的SO2溶于水后形成pH为2的水溶液,其中H+ 的数目为0.01NA
D.含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1×6.02×1023
难度: 中等查看答案及解析
-
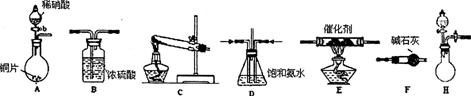
下图装置或操作正确的是
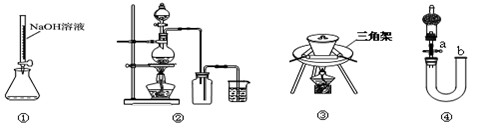
A.用装置①量取15.00ml的NaOH溶液
B.用装置②制备Cl2
C.用装置③高温煅烧CaCO3固体
D.关闭活塞a,从b处加水,以检查装置④的气密性
难度: 中等查看答案及解析
-
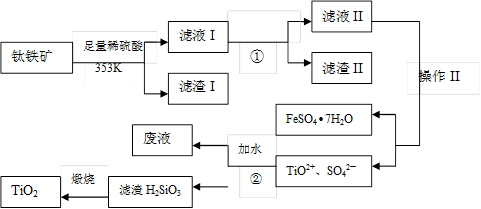
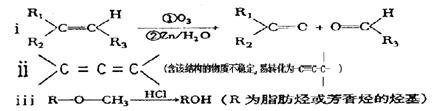
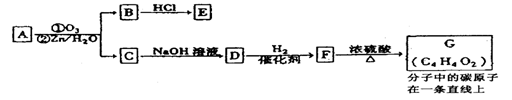
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其它产物已略去):下列说法不正确的是

A.若W是单质铁,则Z溶液可能是FeCl2溶液
B.若X是金属镁,则W可能是强氧化性的单质
C.若W是氢氧化钠,则X与Z可能反应生成Y
D.若X为氧气,则X、Z的相对分子质量可能相差12
难度: 中等查看答案及解析
-
已知25℃时有关弱酸的电离平衡常数:
弱酸化学式
CH3COOH
HCN
H2CO3
电离平衡常数(25℃)
1.8×l0-5
4.9×l0-10
K1=4.3×l0-7 K2=5.6×l0-11
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,溶液中c(Na+)>c(CN-),则a一定大于b
C.冰醋酸中逐滴加水,则溶液的导电性、n(H+)、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,存在c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-)
难度: 中等查看答案及解析
-
某工业生产中有一主要反应:CuFeS2+4Fe3+=5Fe2+ +Cu2++ 2S。下列说法正确的是
A.氧化剂为Fe3+,还原剂为Cu2+和S2+
B.氧化产物是S,还原产物是Fe2+ 和Cu2+
C.当转移1mol电子时,有46 g CuFeS2参加反应
D.氧化剂的氧化性Fe3+>Fe2+ >Cu2+
难度: 中等查看答案及解析
-
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是
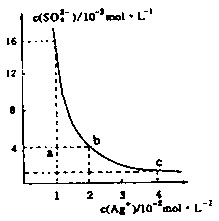
A.b点对应的Ksp等于c点对应的Ksp
B.采取蒸发溶剂的方法可以使溶液从a点变到b点
C.该温度下,Ag2SO4的溶度积常数(Ksp)为1.6×10-5(mol·L-1)2
D.0.02mol·L-1的AgNO3溶液与的0. 2mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
难度: 中等查看答案及解析