-
(15分)我国钛铁矿(主要成分为FeTiO3,还含有Al2O3、SiO2等)的储量居世界首位,用钛铁矿制取TiO2和副产品硫酸亚铁晶体的的流程如下:
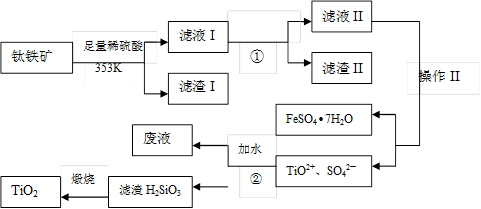
已知:Al(OH)3的Ksp= 1.3ⅹ10-33,Fe(OH)2的Ksp= 1.6ⅹ10-14。
(1)滤液I主要含有TiO2+、SO42—、Fe2+、________(填离子符号);
(2)调节PH应最好使用________;
A.Fe B.Ca(OH)2 C.NH3•H2O D.NaOH
(3)操作II是指洗涤、干燥。
(4)步骤②中发生的化学反应方程式为:________;考虑成本和废物综合利用等因素,生产过程中产生的废液中应加入________处理较合理。
(5)实验室通常将硫酸亚铁进一步制备为硫酸亚铁铵晶体[(NH4)2Fe(SO4)2•6H2O]以利保存,制备方法被收入中学《实验化学》教材中;专家测定晶体含量的办法是:准确称取m g产品溶解定容至250.00ml,移取25.00ml于锥形瓶中,用c mol·L-1的标准KMnO4溶液滴定至________,记录消耗KMnO4溶液的体积为V mL;此时发生的反应为:
5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O,(已知硫酸亚铁铵晶体的相对分子质量为392),则产品中硫酸亚铁铵晶体纯度的计算式可表达为:w%=________。
-
钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料.制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位.含有Fe2O3的钛铁矿(FeTiO3)制取TiO2的流程如下:
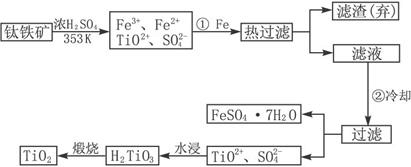
(1)Ti的原子序数为22,Ti位于元素周期表中第________周期,第________族.
(2)步骤①加Fe的目的是________;步骤②冷却的目的是________.
(3)上述制备TiO2的过程中,可以利用的副产物是________;考虑成本和废物综合利用因素,废液中应加入________处理.
(4)由金红石(TiO2)制取单质Ti,涉及到的步骤为:已知:
①C(s)+O2(g)=CO2(g);△H=-393.5kJ•mol-1
②2CO(g)+O2(g)=2CO2(g);△H=-566kJ•mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141kJ•mol-1则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=________.反应TiCl4+2Mg=2MgCl+Ti 在Ar气氛中进行的理由是________.
-
(15分)钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、SiO2等杂质。利用钛铁矿制备二氧化钛,进一步制备钛单质,流程如图:
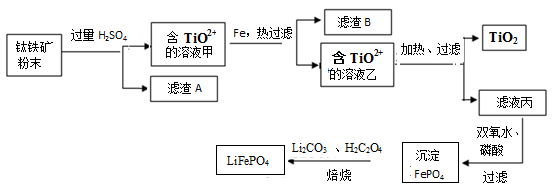
已知:FeTiO3+4H+=Fe2++TiO2++2H2O
草酸(C2H2O4)具有很强还原性,易被氧化成二氧化碳
(1)化合物FeTiO3中铁元素的化合价是 。
(2)钛铁矿加入过量H2SO4后,得到的滤渣A为_______________(填化学式)。
(3)含TiO2+ 溶液乙转化生成TiO2的离子方程式是 。
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是 。
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为Mg/mol)试样wg,消耗c mol/L NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数为 (用代数式表示)。
(6)TiO2制取单质Ti,涉及到的步骤如下:

| TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
反应②的方程式是___________。由TiCl4→Ti需要在Ar气中进行的理由是_____________。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据表中信息,需加热的温度略高于 ℃即可。
| TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
| TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
-
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、SiO2等杂质。利用钛铁矿制备二氧化钛,进一步制备钛单质,流程如图:

已知:FeTiO3+4H+=Fe2++TiO2++2H2O,草酸(H2C2O4)具有很强还原性,易被氧化成二氧化碳。
(1)化合物FeTiO3中铁元素的化合价是 。
(2)钛铁矿加入过量H2SO4后,得到的滤渣A为______ _________(填化学式)。
(3)含TiO2+ 溶液乙转化生成TiO2的离子方程式是 。
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是 。
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为Mg/mol)试样wg,消耗c mol/L NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数为 (用代数式表示)。
(6)TiO2制取单质Ti,涉及到的步骤如下:
| TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
反应②的方程式是___ ____。由TiCl4→Ti需要在Ar气中进行的理由是___ _______。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据表中信息,需加热的温度略高于 ℃即可。
-
工业上以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含有MgO、SiO2等杂质]为原料,制备金属钛和铁红的工艺流程如下:
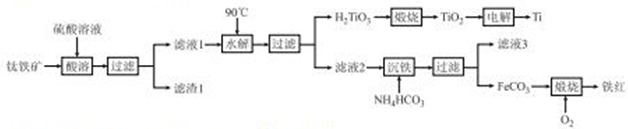
已知:酸酸时,FeTiO3转化为Fe2+和TiO2+ ;
②本实验温度下,Ksp[Mg(OH)2]=1.0×10-11;
③溶液中离子浓度小于等于l .0×10-5mol/L时,认为该离子沉淀完全。
请国答下列问题:
(1)FeTiO3中Ti元素的化合价为_____价,铁红的用途为_____(任写一种)。
(2)“水解”中,发生反应的离子方程式为________。
(3)“沉铁”中,气态产物的电子式为______;该过程需控制反应温度低于35 ℃,原因为_______。
(4)FeCO3转化为铁红时,发生反应的化学方程式为____________。
(5)滤液3可用于制备Mg(OH)2。若滤液3中c(Mg2+)=1.2×10-3mol/L,向其中加入等体积的NaOH溶液的浓度为________ mol/L时,可使Mg2+恰好沉淀完全(溶液体积变化忽略不计)。
(6)“电解”时,电解质为熔融的CaO,则阴极反应式为_______,制得1molTi单质,理论上导线中通过的电量为______(保留三位有效数字,已知:l 个电子的电量为1.6×10-19C ) 。
-
工业上以钛铁矿[主要成分为钛酸亚铁( FeTiO3),含有MgO、SiO2等杂质]为原料,制备金属钛和铁红的工艺流程如下:
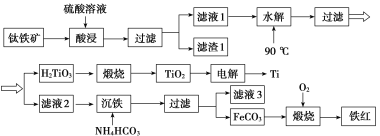
已知:①酸浸时, FeTiO3转化为Fe2+和TiO2+;②本实验温度下,Ksp[Mg(OH)2]=1.0×10-11;请回答下列问题:
(1)酸浸时如何提高浸取速度和浸取率_____________________________(至少答两种方法)。
(2)“水解”生成H2TiO3的离子方程式为_________________________。
(3)“沉铁”过程中,气态产物的电子式为__________________;该过程需控制反应温度低于35 ℃,原因为___________________________________________________。
(4)滤液3可用于制备Mg(OH)2。若滤液3中c(Mg2+)=1.0×10-3 mo/L,向其中加入NaOH固体,调整溶液pH值大于________时,可使Mg2+沉淀完全。
(5)“电解”时,电解质为熔融的CaO,两电极材料为石墨棒。则_______极石墨棒需要定期更换,原因是__________________________________________________________。
(6)测定铁红产品纯度:称取m g铁红,溶于一定量的硫酸之中,配成500.00 mL溶液。从其中量取20.00 mL溶液,加入过量的KI,充分反应后,用 c mol/L硫代硫酸钠(Na2S2O3)标准液滴定至终点,发生反应:I2+2S2O ===S4O
===S4O +2I-。平行滴定三次,硫代硫酸钠平均消耗体积为V mL。则铁红产品的纯度为________(用c、V、m表示)。
+2I-。平行滴定三次,硫代硫酸钠平均消耗体积为V mL。则铁红产品的纯度为________(用c、V、m表示)。
-
工业上以钛铁矿[主要成分为钛酸亚铁( FeTiO3),含有MgO、SiO2等杂质]为原料,制备金属钛和铁红的工艺流程如下:
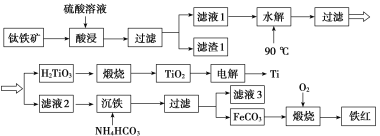
已知:①酸浸时, FeTiO3转化为Fe2+和TiO2+;②本实验温度下,Ksp[Mg(OH)2]=1.0×10-11;请回答下列问题:
(1)酸浸时如何提高浸取速度和浸取率_____________________________(至少答两种方法)。
(2)“水解”生成H2TiO3的离子方程式为_________________________。
(3)“沉铁”过程中,气态产物的电子式为__________________;该过程需控制反应温度低于35 ℃,原因为___________________________________________________。
(4)滤液3可用于制备Mg(OH)2。若滤液3中c(Mg2+)=1.0×10-3 mo/L,向其中加入NaOH固体,调整溶液pH值大于________时,可使Mg2+沉淀完全。
(5)“电解”时,电解质为熔融的CaO,两电极材料为石墨棒。则_______极石墨棒需要定期更换,原因是__________________________________________________________。
(6)测定铁红产品纯度:称取m g铁红,溶于一定量的硫酸之中,配成500.00 mL溶液。从其中量取20.00 mL溶液,加入过量的KI,充分反应后,用 c mol/L硫代硫酸钠(Na2S2O3)标准液滴定至终点,发生反应:I2+2S2O ===S4O
===S4O +2I-。平行滴定三次,硫代硫酸钠平均消耗体积为V mL。则铁红产品的纯度为________(用c、V、m表示)。
+2I-。平行滴定三次,硫代硫酸钠平均消耗体积为V mL。则铁红产品的纯度为________(用c、V、m表示)。
-
工业、上常用钛铁矿[主要成分为FeTiO3(钛酸亚铁,不溶于水)、Fe2O3及少量SiO2杂质]作原料,制取二氧化钛及铁红,其生产流程如图:
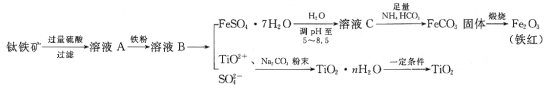
已知:TiO2+易水解,只能存在于强酸性溶液中。
回答下列问题:
(1)钛铁矿用硫酸溶解时,过滤所得滤渣的成分是__(填化学式)。
(2)从溶液B中得到FeSO4·7H2O晶体的操作是__、过滤、洗涤、干燥。
(3)溶液C中加入NH4HCO3,发生反应的离子方程式是__。
(4)煅烧FeCO3,发生反应的化学方程式是__。
(5)流程中加入Na2CO3粉末得到固体TiO2·nH2O。请结合TiO2+的水解平衡原理解释其原因:__。
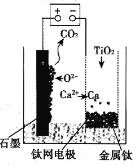
(6)用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制取金属钛。阳极反应式是__,反应过程中CaO的物质的量__(填“减小”“不变”或“增大”)。
-
二氧化钛(TiO2)广泛用于制造高级白色油漆,也是许多反应的催化剂.工业上用钛铁矿[主要成分为FeTiO3(钛酸亚铁,不溶于水)、Fe2O3及少量SiO2杂质]作原料,制取二氧化钛及绿矾,其生产流程如下:
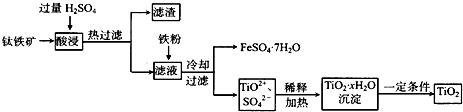
回答下列问题:
(1)Ti原子序数为22,则Ti位于周期表第________周期,第________列.
(2)FeTiO3溶于过量硫酸的离子方程式________.
(3)流程中生成TiO2•xH2O离子方程式为________.
(4)若铁粉的用量不足,可能导致产品TiO2中混有________杂质.
(5)以TiO2为原料制取金属钛的其中一步反应为TiO2+Cl2+C TiCl4+________,已知该反应中氧化剂与还原剂的物质的量之比为1:1,则另一生成物为________.
TiCl4+________,已知该反应中氧化剂与还原剂的物质的量之比为1:1,则另一生成物为________.
(6)TiCl4 在常温下呈液态,且极易水解,可以用作军事烟雾剂;写出其水解反应的方程式________.
-
二氧化钛(TiO2)广泛用于制造高级白色油漆,也是许多反应的催化剂.工业上用钛铁矿[主要成分为FeTiO3(钛酸亚铁,不溶于水)、Fe2O3及少量SiO2杂质]作原料,制取二氧化钛及绿矾,其生产流程如下:
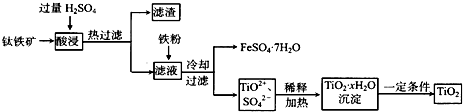
回答下列问题:
(1)Ti原子核外电子层数为4,位于元素周期表第ⅣB族.Ti原子序数为______.
(2)FeTiO3溶于过量硫酸的离子方程式______.
(3)流程中生成TiO2•xH2O离子方程式为______.
(4)若铁粉的用量不足,可能导致产品TiO2中混有______杂质.
(5)以TiO2为原料制取金属钛的其中一步反应为TiO2+Cl2+C TiCl4+______,已知该反应中氧化剂与还原剂的物质的量之比为1:1,则另一生成物为______.
TiCl4+______,已知该反应中氧化剂与还原剂的物质的量之比为1:1,则另一生成物为______.











