-
下列物质的分类结果全部正确的是
A.焦炉气—混合物 胆矾—纯净物 臭氧—单质
B.纯碱—碱 硫化氢—酸 小苏打—酸式盐
C.油脂—高分子化合物 纤维素—天然高分子化合物 有机玻璃—合成高分子化合物
D.液氯—非电解质 硫酸钡—强电解质 醋酸—弱电解质
难度: 简单查看答案及解析
-
下列关于Fe(OH)3胶体的说法中不正确的是
A.Fe(OH)3胶体与硅酸溶液混合将产生凝聚现象
B.Fe(OH)3胶体粒子在电场影响下将向阳极移动
C.液溶胶中Fe(OH)3胶体粒子不停地做布朗运动
D.光线通过Fe(OH)3胶体时会发生丁达尔现象
难度: 简单查看答案及解析
-
将n molCu2S的与足量的稀硝酸反应,生成硝酸铜、硫酸、一氧化氮和水,则参加反应的硝酸中被还原的硝酸的物质的量是
A.4n mol B.10n mol C.10n/3 mol D.2n/3 mol
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.1mol·L-1NaCl溶液含有NA个Na+
B.任意条件下,16g O3所含的原子数为NA
C.由CH4和C2H6组成的混合物中共有NA个分子,其中的氢原子数为5NA
D.标准状况下,22.4 L SO3所含的分子数为NA
难度: 简单查看答案及解析
-
向饱和石灰水中不断通入二氧化碳,其溶液导电性的变化是
A.由弱变强 B.由强变弱 C.由强变弱,再变强 D.由弱变强,再变弱
难度: 简单查看答案及解析
-
下列离子方程式中正确的是
A.稀硫酸滴在铜片上:Cu + 2H+ = Cu2+ +H2↑
B.用小苏打治疗胃酸过多:HCO3- + H+ = H2O + CO2↑
C.硝酸滴在石灰石上:CaCO3+ 2H+= Ca2+ +H2CO3
D.醋酸钠和盐酸混和:CH3COONa + H+= CH3COOH + Na+
难度: 简单查看答案及解析
-
阿伏加德罗常数的值约为6.02×1023mol-1,下列叙述中不正确的是
①12.4g白磷晶体中含有的P-P键数约是0.6×6.02×1023
②电解精炼铜时转移了6.02×1023个电子,阳极溶解32 g铜
③7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1×6.02×1023
④2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2×6.02×1023
⑤2.9g 2CaSO4·H2O含有的结晶水分子数为0.02×6.02×1023 (2CaSO4·H2O式量为290)
⑥含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
A.①④⑥ B.①③④⑤⑥ C.②③⑤⑥ D.③④⑤⑥
难度: 简单查看答案及解析
-
下列溶液中,有关离子一定能大量共存的是
A.能使石蕊呈蓝色的溶液中: Na+、I-、Cl-、NO3-
B.能使甲基橙呈黄色的溶液中:K+、SO32-、SO42-、ClO-
C.能使pH试纸变红色的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+
D.无色溶液中:K+、Cl-、NO
、SO
难度: 简单查看答案及解析
-
某溶液中含有HCO
、SO
、CO
、CH3COO- 4种阴离子.若向其中加入足量的Na2O2后,溶液中离子浓度基本保持不变的是
A.CH3COO- B.SO
C.CO
D.HCO
难度: 简单查看答案及解析
-
在水电离出的C(H+)=10-14mol/L的溶液中,一定能大量共存的离子组是
A.K+、Na+、HCO3-、Cl- B.K+、AlO2-、Br-、Cl-
C.Na+、Cl-、NO3-、SO42- D.Al3+、NH4+、Cl-、SO42-
难度: 简单查看答案及解析
-
X、Y、Z为三种单质。已知:Y能将Z从其化合物的水溶液中置换出来,而Z又能将X从其化合物中置换出来。由此可以推断下列说法中可能正确的是
①单质的氧化性:Y>Z>X;
②单质的还原性:Y>Z>X;
③对应离子的氧化性:X>Z>Y;
④对应离子的还原性:X>Z>Y
A.只有① B.只有②③ C.只有①④ D.①②③④
难度: 简单查看答案及解析
-
标准状况下,往100mL 0.1mol/L的FeBr2溶液中通入一定体积的Cl2,充分反应后,溶液中有50%的Br-被氧化。则通入的氯气的体积是
A.0.224L B.0.336L C.0.448L D.0.672L
难度: 简单查看答案及解析
-
在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,每摩尔CuSO4能氧化P的物质的量为
A.1/5 mol B.2/5 mol C.3/5mol D.11/5 mol
难度: 简单查看答案及解析
-
多硫化钠Na2Sx(x≥2)在结构上与Na2O2,FeS2等有相似之处,Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,而NaClO被还原成NaCl,反应中Na2Sx与NaClO的量之比为1:16,则x值是
A.5 B.4 C.3 D.2
难度: 简单查看答案及解析
-
向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24mol B.0.21mol C.0.16mol D.0.14mol
难度: 简单查看答案及解析
-
自然界中存在一种尖晶石,化学式可表示为MgAl2O4,它透明色美,可作为宝石。已知该尖晶石中混有Fe2O3。取一定量样品5.4g,恰好完全溶解在一定浓度100 mL盐酸溶液中,盐酸浓度可能是
A.2.8 mol·L-1 B.3.8 mol·L-1
C.4.3 mol·L-1 D.4.9 mol·L-1
难度: 简单查看答案及解析
-
下图是几种盐的溶解度曲线,下列说法中正确的是
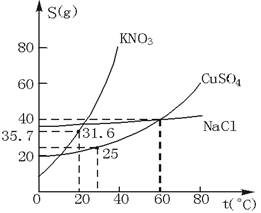
A.40℃时,将35 g食盐溶于100 g水中,降温至0℃时,可析出NaCl晶体
B.20℃时KNO3饱和溶液的溶质质量分数为31.6%
C.60℃时,200 g水中溶解80 g CuSO4达饱和,当降温至30℃时,可析出30 g硫酸铜晶体
D.30℃时,将35 g KNO3和35 g NaCl同时溶于100 g水中,蒸发时先析出的晶体是NaCl
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是
A.铜片插入氯化铁溶液中 Cu+Fe3+=Cu2++Fe2+
B.电解饱和食盐水 2Cl—+2H+
H2↑+C12↑
C.碳酸钙与盐酸反应 CaCO3+2H+ = Ca2++CO2↑ +H2O
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液
NH4++Al3++2SO42—+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O
难度: 简单查看答案及解析