-
化学与社会、技术、环境、生活密切相关。下列说法正确的是( )
A.碘是人体必需的微量元素,所以要多吃富含高碘酸的食物
B.空气中直径小于或等于2.5µm的颗粒物称为PM2.5
C.pH<7的雨水称为酸雨,对环境造成很大的危害
D.甲醛的水溶液可以作为鱿鱼等海鲜的防腐剂
难度: 简单查看答案及解析
-
下列装置或操作能达到相应实验目的的是( )
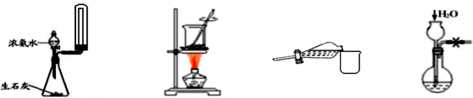
A.制备少量氨气 B.海带灼烧成灰 C.分液时取出下层液体 D.检查气密性
难度: 简单查看答案及解析
-
a、b、c、d都是短周期元素,原子半径d>c>a>b,其中a、b处在同一周期,a、c处在同一主族。c原子核内质子数等于a和b的原子核内质子数之和,c原子最外层上的电子数是d原子最外层电子数的4倍。下列说法不正确的是( )
A.a、c两元素位于元素周期表的ⅣA族
B.d单质在b单质中燃烧生成的化合物中阴阳粒子个数比为1:1
C.单质c可以和d的最高价氧化物的水化物发生反应
D.工业上可用单质a冶炼单质c
难度: 困难查看答案及解析
-
NA表示阿伏伽德罗常数的值,下列叙述错误的是( )
A.2gD216O中含有的质子数、中子数、电子数均为NA
B.78gNa2O2和Na2S的混合物中含有的Na+ 数一定为2NA
C.标准状况下,5.6LO2作氧化剂时转移电子数一定为NA
D.500mL 2mol/LNa2CO3溶液中含C微粒总数一定为NA
难度: 中等查看答案及解析
-
分子式为C9H12O,苯环上有两个取代基且含羟基的化合物,其可能的结构有( )
A.9种 B.12种 C.15种 D.16种
难度: 困难查看答案及解析
-
海水中含有多种元素,开发利用这些资源是科学研究的重要课题。下图为海水利用的部分过程,下列有关说法正确的是( )
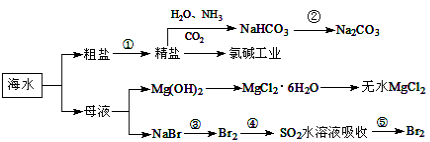
A.要实现反应②可向NaHCO3溶液中加入过量石灰水
B.氯碱工业中采用阴离子交换膜提高产品纯度
C.MgCl2溶液加热蒸干可得无水MgCl2
D.溴元素在反应③、⑤中均被氧化,在反应④中被还原
难度: 困难查看答案及解析
-
下列图示与对应的叙述相符的是( )
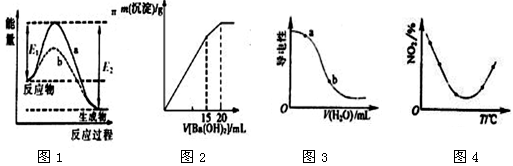
A.图1表示某放热反应在无催化剂(a)和有催化剂(b)时反应的能量变化,且加入催化剂改变反应的焓变
B.图2表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全
C.图3表示在CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
D.图4表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:
2NO2(g)
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
难度: 极难查看答案及解析
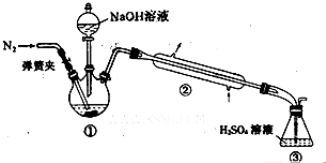
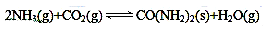
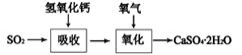

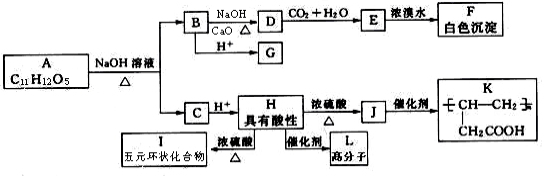
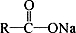 + NaOH
+ NaOH