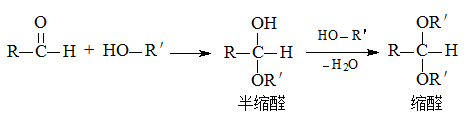
-
化学与生产、生活和科研密切相关,下列说法错误的是
A. 用菜籽油浸泡花椒制得花椒油的过程未发生化学变化
B. 河水中有许多杂质和有害细菌,加入明矾消毒杀菌后可以饮用
C. 把浸泡过KMnO4溶液的硅藻土放在水果箱里可延长水果的保鲜期
D. 对医疗器械高温消毒时,病毒蛋白质受热变性
难度: 简单查看答案及解析
-
下列关于常见有机物的说法正确的是
A.乙醚和乙醇互为同分异构体
B.糖类、油脂、蛋白质均能发生水解反应
C.聚氯乙烯可用作生产食品包装材料的原料
D.分子式为C3H8O的有机物,只有2种能发生酯化反应
难度: 简单查看答案及解析
-
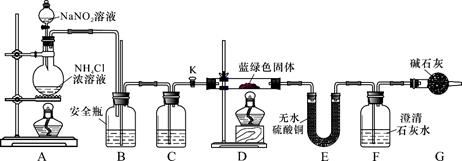
利用下图所示装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测其中现象正确的是
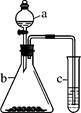
选项
a
b
c
c试管中现象
A
浓盐酸
KMnO4
FeCl2溶液
溶液变棕黄色
B
稀硫酸
Na2S2O3
溴水
产生浅黄色沉淀
C
硼酸
Na2CO3
Na2SiO3溶液
析出白色沉淀
D
浓硝酸
铁片
KI-淀粉溶液
溶液变蓝色
难度: 简单查看答案及解析
-
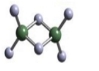
从薄荷中提取的薄荷醇可制成医药。薄荷醇的结构简式如下图,下列说法正确的是
A. 薄荷醇分子式为C10H20O,它是环己醇的同系物
B. 薄荷醇的分子中至少有12个原子处于同一平面上
C. 薄荷醇在Cu或Ag做催化剂、加热条件下能被O2氧化为醛
D. 在一定条件下,薄荷醇能发生取代反应、消去反应和聚合反应
难度: 简单查看答案及解析
-
用FeS2纳米材料制成的高容量锂电池,电极分别是二硫化亚铁和金属锂,电解液是含锂盐的有机溶剂。下列说法错误的是
A. 金属锂作电池的负极
B. 电池正极反应为FeS2+4Li++4e-==Fe+2Li2S
C. 放电时,Li+向负极迁移
D. 电池总反应为FeS2+4Li ==Fe+2Li2S
难度: 简单查看答案及解析
-
采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质) 制取绿矾(FeSO4·7H2O),某学习小组设计了如下流程:
下列说法错误的是
A.酸浸时选用足量硫酸,试剂X为铁粉
B.滤渣a主要含SiO2,滤渣b主要含Al(OH)3
C.从滤液B得到绿矾产品的过程中,必须控制条件防止其氧化和分解
D.试剂X若为过量NaOH溶液,得到的沉淀用硫酸溶解,再结晶分离也可得绿矾
难度: 简单查看答案及解析
-
常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示。下列有关叙述正确的是
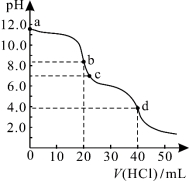
A.a点溶液呈碱性的原因用离子方程式表示为:CO
+2H2O
H2CO3+2OH-
B.c点处的溶液中c(Na+)-c(Cl-)=c(HCO
)+2c(CO
)
C.滴定过程中使用甲基橙作为指示剂比酚酞更准确
D.d点处溶液中水电离出的c(H+)大于b点处
难度: 简单查看答案及解析