-
【化学——选修3:物质结构与性质】
A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是_________,基态D原子价电子的轨道表达式为____________,DA2分子的VSEPR模型是____________。
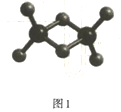
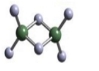
(2)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6 在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
① C2Cl6属于____________晶体(填晶体类型),其中C原子的杂化轨道类型为____________杂化。
② [C(OH)4]-中存在的化学键有___________。
③C2Cl6与过量的NaOH溶液反应的化学方程式为_________。
(3)B、C的氟化物晶格能分别是2957 kJ·mol-1、5492 kJ·mol-1,二者相差很大的原因是____________。
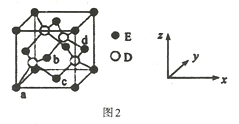
(4)D与E所形成化合物晶体的晶胞如图1所示。
① 在该晶胞中,E的配位数为______________。
② 原子坐标参数可表示晶胞内部各原子的相对位置。图2晶胞中,原子坐标a为(0,0,0);b为(1/2,0,1/2);c为(1/2,1/2,0),则D原子的坐标参数为________。
③ 已知该晶胞的密度为ρ g/cm3,则其中两个D原子之间的距离为_________ pm(列出计算式即可)
-
[化学—选修3:物质结构与性质]A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是 ,基态D原子价电子的轨道表达式为 。
(2)DA2分子的VSEPR模型是 。H2A比H2D熔沸点高得多的原因是 。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6 在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
① C2Cl6属于 晶体(填晶体类型),其中C原子的杂化轨道类型为 杂化。
② [C(OH)4]-中存在的化学键有 。
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是 。
(5)B、C的氟化物晶格能分别是2957 kJ·mol-1、5492 kJ·mol-1,二者相差很大的原因是____________。
(6)D与E所形成化合物晶体的晶胞如图所示。
① 在该晶胞中,E的配位数为______________。
② 原子坐标参数可表示晶胞内部各原子的相对位置。右图晶胞中,原子坐标参数a为(0,0,0);b为( ,0,
,0, );c为(
);c为( ,
, ,0)。则d原子的坐标参数为_________________。
,0)。则d原子的坐标参数为_________________。
③ 已知该晶胞的密度为ρ g/cm3,则其中两个D原子之间的距离为_________ pm(列出计算式即可)。
-
[化学—选修3:物质结构与性质]
A、B、C、D、E是前四周期原子序数依次增大的五种元素。A元素原子的核外电子等于其电子层数;B元素基态原子有三个能级电子数相同;A和D可形成两种常见液态化合物甲、乙,其原子数之比分别为1:1,2:1;E元素原子的K、L层电子数之和等于其M、N层电子数之和。回答下列问题(涉及元素用相应化学符号表示):
(1)B、C、D三种元素中电负性最大的元素其基态原子的电子排布式为 。
(2)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。在B的基态原子中,核外存在 对自旋相反的电子。
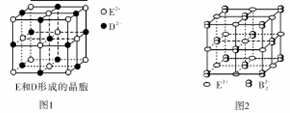
(3)由E和D形成的晶胞如图1所示,晶体中E2+周围等距且最近的E2+有 个;ED的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,焰色反应的原理是 。E和B可形成的晶体的晶胞结构与NaCl晶体的相似(如图2所示),但该晶体中含有的哑铃形B22-的存在,使晶胞沿一个方向拉长。晶体中E2+的配位数为_______________;该化合物的化学式为 。
(4)用高能射线照射液态化合物乙时,一个乙分子能释放出一个电子,同时产生一种阳离子。
①释放出来的电子可以被若干乙分子形成的“网”捕获,乙分子间能形成“网”的原因是 。
②由乙分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式 。
-
【化学——选修3:物质结构与性质】
X、Y、Z、W为前四周期元素且原子序数依次增大,X的电子层数等于核外电子数,Y元素基态原子核外未成对电子数为2且X与Y形成的化合物在常温下为常见的液体R,Z元素原子最外电子层上s、p电子数相等,W基态原子3d轨道的电子数是4s轨道电子数的3倍。请回答下列问题:
(1)Y基态原子的价电子排布图为 ,其第一电离能在同周期元素中由大到小排第 位。
(2)W的元素名称为 ,其基态原子核外有 种空间运动状态不同的电子。
(3)R的中心原子采取的杂化方式为 ,写出R的一个等电子体: 。(填化学式)。
(4)Z与Y在一定条件下可形成高硬度的化合物,该化合物的晶体类型为 ,其由Z、Y构成的最小环为 元环。
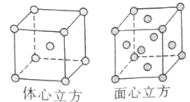
(5)W的单质在900℃以下为α型体心立方晶胞,910℃以上W转变为γ型面心立方晶胞,晶胞结构分别如图所示。两种晶体中距离最近的铁原子间距离相同。则在800℃和1000℃下,铁的密度之比为 。
-
【化学选修—物质结构与性质】
原子序数依次增大的U、V、W、X、Y是周期表中前30号元素。已知U的最外层电子数是其内层电子数的2倍,U与W形成的常见化合物之一是主要的温室气体;X与U同主族,其单质在同周期元素所形成的单质中熔点最高;Y原子M能层为全充满状态,且核外的未成对电子只有一个,请回答下列问题:
(1)V在周期表中的位置是___________,该主族元素的气态氢化物中,沸点最低的是________(填化学式);
(2)根据等电子原理分析,VW2+中V原子的轨道杂化类型是__________;
(3)五种元素中,电负性最大与最小的两种非金属元素形成的化合物在常温下是晶体,其晶体类型是__________;
(4)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测X元素的电离能突增应出现在第_________电离能;
(5)U的一种相对分子质量为28的氢化物,其分子中σ键与π键的个数之比为_________;
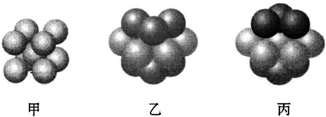
(6)Y的基态原子有_________种形状不同的原子轨道;Y2+的价电子排布式为__________;如图_________(填“甲”“乙”或“丙”)表示的是Y晶体中微粒的堆积方式。
-
【化学-选修3:物质结构与性质】
A、B、C、D、E五种常见元素的核电荷数依次增大。A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子。请回答下列问题:
(1)E的基态原子价层电子排布式为________________。
(2)AB2分子中,A的杂化类型为________________;在元素周期表中A、B及与两者紧邻的元素的第一电离能由大到小的顺序为(用元素符号表示)__________________。
(3)B的氢化物与D的氢化物的沸点较高的是____________(用化学式表示),原因是______________。
(4)AB2形成的晶体的熔点____________(填“高于”“低于”或“无法判断”)CD形成的晶体的熔点,原因是___________________。
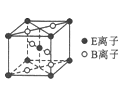
(5)E与B形成的一种橙红色晶体晶胞结构如图所示,其化学式为____________(用元素符号表示)。ED4是制取航天航空工业材料的重要原料。取上述橙红色晶体,放在电炉中,通入D2和A的单质后高温加热,可制得ED4,同时产生一种造成温室效应的气体,写出反应的化学方程式:_________________________。
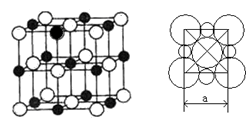
(6)由C、D两元素形成的化合物组成的晶体中,晶体结构图以及晶胞的剖面图如下图所示,若晶胞边长是acm,则该晶体的密度为____________g/cm3.(已知阿伏加德罗常数为NA)
-
[化学—选修3物质结构与性质] T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/molkJ/mol,I4=11575kJ/mol |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
(1)TY2是一种常用的溶剂,是 (填极性分子或非极性分子),分子中存在 个σ 键。W的最简单氢化物容易液化,理由是 。
(2)在25℃、101kpa下,已知13.5g的X固体单质在O2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为 。
(3)基态Y原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 、电子数为 。Y、氧、W元素的第一电离能由大到小顺序为 (用元素符号作答)。
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为 ;ZYO4常作电镀液,其中YO42-的空间构型是 ,其中Y原子的杂化轨道类型是 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是
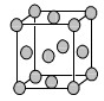
A.O2是 氧化剂
B.HO2 是氧化产物
C. HO2在碱中能稳定存在
D.1 mol Z参加反应有1 mol电子发生转移
-
[化学—选修3物质结构与性质] T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/molkJ/mol,I4=11575kJ/mol |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
(1)TY2是一种常用的溶剂,是 (填极性分子或非极性分子),分子中存在 个σ 键。W的最简单氢化物容易液化,理由是 。
(2)在25℃、101kpa下,已知13.5g的X固体单质在O2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为 。
(3)基态Y原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 、电子数为 。Y、氧、W元素的第一电离能由大到小顺序为 (用元素符号作答)。
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为 ;ZYO4常作电镀液,其中YO42-的空间构型是 ,其中Y原子的杂化轨道类型是 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是
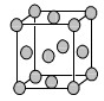
A.O2是 氧化剂
B.HO2 是氧化产物
C. HO2在碱中能稳定存在
D.1 mol Z参加反应有1 mol电子发生转移
-
[化学—选修3物质结构与性质] T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/molkJ/mol,I4=11575kJ/mol |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
(1)TY2是一种常用的溶剂,是 (填极性分子或非极性分子),分子中存在 个σ 键。W的最简单氢化物容易液化,理由是 。
(2)在25℃、101kpa下,已知13.5g的X固体单质在O2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为 。
(3)基态Y原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 、电子数为 。Y、氧、W元素的第一电离能由大到小顺序为 (用元素符号作答)。
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为 ;ZYO4常作电镀液,其中YO42-的空间构型是 ,其中Y原子的杂化轨道类型是 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是
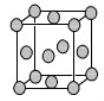
A.O2是 氧化剂
B.HO2 是氧化产物
C. HO2在碱中能稳定存在
D.1 mol Z参加反应有1 mol电子发生转移
-
【化学——选修3:物质结构与性质】T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
| 元索 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一离能至第四电离能分别I1="578" kJ/mol; I2=" l817" kJ/mol;I3="2745" kJ/mol;I4=11575kJ/mol |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
(1) TY2是一种常用的溶剂,是__________(填“极性分子”或“非极性分子”),分子中存在________个σ键。
(2)W的最简单氢化物容易液化,理由是__________,.放热419 kJ,该反应的热化学方程式为 __________。
(3)基态Y原子中,电子占据的最高能层符号为__________,该能层具有的原子轨道数为_____________、电子数为_________。Y、氧、W元素的第一电离能由大到小的顺序为_________(用元素符号作答)。
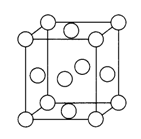
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为___________cm;ZYO4常作电镀液,其中ZYO42-的空间构型是__________,其中Y原子的杂化轨道类型是___________。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z +HCl+O2=ZC1+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是
A.O2是氧化剂
B.HO2是氧化产物
C.HO2在碱中能稳定存在
D.1 mol Z参加反应有1 mol电子发生转移

,0,
);c为(
,
,0)。则d原子的坐标参数为_________________。










