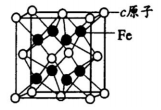
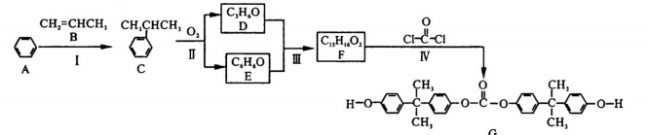
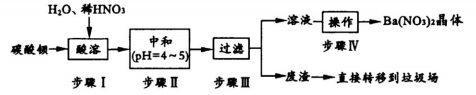
-
下列物质加工或应用中未利用其化学性质的是
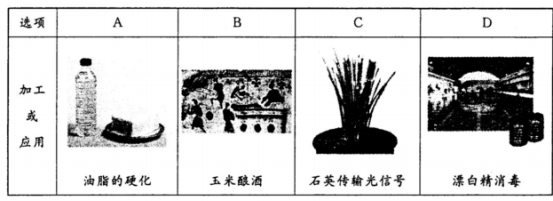
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.10℃时,lLpH=1.0的H2SO4溶液中含H+为0.1NA
B.常温下,14g的14C含中子数目为6NA
C.标况下11.2LNO与11.2LO2混合,原子总数小于2NA
D.0.1mol苯乙烯含碳碳双键为0.4NA
难度: 困难查看答案及解析
-
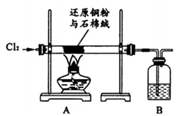
如图依次为气体制得、除杂并检验其性质的装置(加热及夹持仪器省略)。下列设计不能达到目的的是
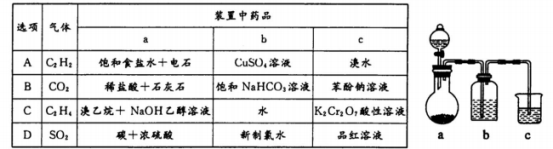
难度: 困难查看答案及解析
-
下列有关0.1L 0.1mol/LKMnO4酸性溶液的叙述正确的是
A.与少量乙二醛混合可制备乙二酸
B.与浓盐酸反应的离子方程式为:2MnO2+16H++10C1一=5Cl2十+2Mn2++8H20
C.与K+、NO3-、SO42-、CO32—可以大量共存
D.与过量Na202混合后,共转移e-0.05mol
难度: 困难查看答案及解析
-
研究人员发现了一种“水’’电池,其总反应为:5Mn02 +2Ag+2NaCI=Na2Mn5O10 +2AgCl。如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出。下列有关分析正确的是

A.I为负极,其电极反应式为Ag+Cl--e一=AgCl
B.“水”电池内Na+不断向负极作定向移动
C.每转移Imole-,U型管中消耗0.5molH2O
D.开始时U型管中Y极附近pH逐渐增大
难度: 困难查看答案及解析
-
常温下,向20mL 0.5mol.L-的CH3 COOH溶液中逐滴滴加0.5mol.1-1的NaOH溶液,滴定曲线如图。相关分析正确的是
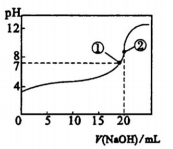
A.滴加至①时,c(Na+)=c(CH3COO-),酸碱恰好完全反应
B.滴加至②时,c(OH-)一c(H+)=c(CH3COOH)
C.滴定中,c(CH3C00-)/c(H+)逐渐减小
D.滴定中.c(CH3COOH)与c(CHaC00-)之和保持不变
难度: 中等查看答案及解析
-
在初始温度为500℃、容积恒定为10L的三个密闭容器中,如图充料发生反应:CO2 (g)+3H2 (g)
CH30H(g)十H2 0(g)△H- -25k/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析正确的是
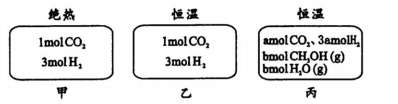
A.刚开始反应时速率:甲>乙 B.平衡后反应放热:甲>乙
C.500℃下该反应平衡常数:K =3×102 D.若a≠0,则0.9<b<l
难度: 中等查看答案及解析