-
有一支50mL酸式滴定管中盛盐酸,液面恰好在amL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是

A.a mL B.(50―a)mL C.大于(50―a)mL D.大于a mL
难度: 简单查看答案及解析
-
用0.1026mol·L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如右图所示,正确的读数为
A. 22.30mL B. 22.35mL C. 23.65mL D. 23.70 mL
难度: 简单查看答案及解析
-
下列实验操作和数据记录都正确的是
A.用托盘天平称量时,将NaOH固体放在右盘内的滤纸上,称得质量为10.2 g
B.用25mL碱式滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL
C.用湿润的pH试纸测稀盐酸溶液的pH,pH=3
D.用10mL量筒粗略量取NaCl溶液,体积为9.25 mL
难度: 简单查看答案及解析
-
室温时,某溶液中由水电离生成的H+和OH-物质的量浓度的乘积为10-24,则在该溶液中一定不能大量共存的离子组是。
A.Al3+、Na+、NO3-、Cl- B.K+、Na+、Cl-、CO32-
C.K+、Na+、Cl-、SO42- D.NH4+、K+、SiO32-、NO3-
难度: 简单查看答案及解析
-
醋酸是电解质,下列事实能说明醋酸是弱电解质的组合是
①醋酸与水能以任意比互溶 ②醋酸溶液能导电
③醋酸溶液中存在醋酸分子 ④0.1 mol·L-1醋酸的pH比0.1 mol·L-1盐酸pH大
⑤醋酸能和碳酸钙反应放出CO2 ⑥0.1 mol·L-1醋酸钠溶液pH=8.9
⑦大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢
A.②⑥⑦ B.③④⑤⑥ C.③④⑥⑦ D.①②
难度: 简单查看答案及解析
-
在pH都等于10的NaOH和CH3COONa两种溶液中,设由水电离产生的OH- 离子浓度分别为Amol/L与Bmol/L,则A和B关系为
A.A>B B.A=10-6 B C.B=10-6 A D.A=B
难度: 简单查看答案及解析
-
常温下,1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于
A.9.0 B.9.5 C.10.5 D.12.5
难度: 简单查看答案及解析
-
将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
难度: 简单查看答案及解析
-
下列有关说法中正确的是( )
A. 焓变大于零的反应一定不能自发进行
B. 焓变小于零的反应一定能自发进行
C. 焓变小于零且熵增加的过程对应的反应能自发进行
D. 对于同一物质来讲,熵值的大小与其状态有关,固态物质的熵值最大
难度: 简单查看答案及解析
-
下列离子方程式中正确的是
A.氢氧化钠溶液吸收过量的二氧化碳:OH-+CO2 = HCO3-
B.亚硫酸氢铵溶液与足量氢氧化钠溶液反应:HSO3-+ OH-= SO32-+ H2O
C.氯气通入冷水中:Cl2 +H2O = Cl- +ClO- +2H+
D.碳酸镁悬浊液中加醋酸:CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
难度: 简单查看答案及解析
-
下列叙述正确的是:
A.0.1 mol/LCH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.室温下,Na2CO3溶液加水稀释后, pH和Kw均减小
C.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
D.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
难度: 简单查看答案及解析
-
含等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,设消耗CH3COOH溶液的体积依次为
,则两者的关系正确的是
难度: 简单查看答案及解析
-
氢氧化钠标准溶液因保存不当,吸收了少量的二氧化碳,若有1%的NaOH转变为Na2CO3,以此NaOH溶液滴定未知浓度的盐酸,选用甲基橙作指示剂,盐酸浓度的测定结果会
A.偏低1% B.偏高1% C.无影响 D.偏高0.1%
难度: 简单查看答案及解析
-
常温下,0.1 mol/L某一元酸(HA)溶液中
=1×10-8,下列叙述正确的是
A.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
B.溶液中c(H+)+c(A-)=0.1 mol/L
C.溶液中水电离出的c(H+)=10-10 mol/L
D.与0.05mol/L NaOH溶液等体积混合后所得溶液中离子浓度大小关系为
c(A-)>c(Na+)>c(OH-)>c(H+)
难度: 简单查看答案及解析
-
常温下pH=3的二元弱酸H2R溶液与a L pH=11的NaOH溶液混合后,混合液的pH刚好等于7(假设反应前后体积不变),则对反应后混合液的叙述正确的是
A.c(R2-)+ c(OH-)=c(Na+)+c(H+) B.c(R2-)>c(Na+)>c(H+)=c(OH-)
C.混合后溶液的体积为2a L D.2c(R2-)+ c(HR-)=c(Na+)
难度: 简单查看答案及解析
-
常温下,有甲、乙两份体积均为l L,浓度均为0.1mol/L的氨水,其pH为11。①甲用蒸馏水稀释100倍后,溶液的pH将为a;②乙与等体积、浓度为0.2mol/L的盐酸混合,在混合溶液中:n(NH4+)+n(H+)-n(OH-)=bmol。则a、b正确的答案组合是
A.9~11之间; 0.1 B.9~11之间; 0.2
C.12~13之间; 0.2 D.13; 0.1
难度: 简单查看答案及解析
-
已知甲酸钠(HCOONa)溶液呈碱性。室温下用pH相同、体积相同的盐酸与甲酸(HCOOH)溶液分别进行如下实验,下列相关叙述正确的是
A.分别加入等体积水稀释,盐酸中c(H+)比甲酸中c(H+)小
B.分别用等物质的量浓度的NaOH溶液中和,盐酸比甲酸消耗的碱液少
C.分别跟等质量铝粉反应,盐酸比甲酸的起始反应速率快
D.分别跟过量的锌粒反应,盐酸比甲酸产生氢气的量多
难度: 简单查看答案及解析
-
已知25℃时有关
弱酸的电离平衡常数:则下列有关说法正确的是
弱酸化学式
CH3COOH
HCN
H2CO3
电离平衡常数(25℃ )
1.8×l0-5
4.9×l0-10
K1=4.3×l0-7
K2=5.6×l0 -11
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L—1 HCN溶液与b mol·L—1 NaOH溶液等体积混合后,所得溶液中
c(CN-)>c(Na+),则a一定大于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-)
难度: 简单查看答案及解析
-
在100毫升某一元弱酸(Ka=10-3~10-7)的溶液中,以0.50mol/L氢氧化钠溶液滴定后得滴定曲线如下图所示,下列叙述正确的是:
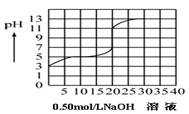
A.该弱酸在滴定前的浓度是0.15 mol/L:
B.该弱酸的电离常数(Ka)是10-5
C.在滴定过程,为求滴定终点,最合适的指示剂是酚酞
D.在滴定过程,为求滴定终点,最合适的指示剂是甲基橙
难度: 简单查看答案及解析
-
室温下,在25 mL 0.1 mol/LNaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,曲线如右图所示,若忽略两溶液混合时的体积变化,有关粒子浓度关系比较错误的是

A.在A、B间任一点,溶液中一定都有:c(Na+)+c(H+)= c(CH3COO-)+c(OH-)
B.在B点:a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(Na+)>c(CH3COO-) >c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=0.1mol/L
难度: 简单查看答案及解析
-
已知某温度下,0.1mol·L-1 NaHA的强电解质溶液中,c(H+) < c(OH-),
则下列关系一定正确的是
A.c(Na+) = c(HA-) + 2c(A2-) + c(OH-)
B.c(H+)·c(OH-) = 10-14
C.c(H2A) + c(HA-) + c(A2-) = 0.1 mol·L-1
D. c(A2-) + c(OH-) = c(H+) + c(H2A)
难度: 简单查看答案及解析
-
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

A.加入Na2 SO4可以使溶液由a点变到c点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
难度: 简单查看答案及解析
