-
不同元素的原子(包括离子)
A.质子数一定不等 B.中子数一定不等
C.质量数一定不等 D.核外电子数一定不等
难度: 简单查看答案及解析
-
元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化 B.元素原子量依次递增
C.元素原子最外层电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
难度: 简单查看答案及解析
-
已知2SO2+O2
2SO3为放热反应,对该反应的下列说法中正确的是
A.O2的能量一定高于SO2的能量 B.SO2和O2的总能量一定高于SO3的总能量
C.SO2的能量一定高于SO3的能量 D.因该反应为放热反应,故不必加热就可发生
难度: 简单查看答案及解析
-
对化学反应限度的叙述,错误的是
A.任何可逆反应都有一定的限度 B. 化学反应的限度是不可改变的
C.化学反应的限度与时间的长短无关 D. 化学反应达到限度时,正逆反应速率相等
难度: 简单查看答案及解析
-
由甲烷的结构式不能获得的信息是
A 一个甲烷的分子由一个碳原子和四个氢原子构成
B 甲烷的摩尔质量为16g/mol
C 甲烷分子中一个碳氢原子之间共用一个电子对
D 甲烷分子的空间构型为正四面体型
难度: 简单查看答案及解析
-
下列物质中,含有非极性共价键的是
A.N2 B.CO2 C.NaOH D.CH4
难度: 简单查看答案及解析
-
在2L容器中发生反应N2+3H2
2NH3,经一段时间后NH3的物质的量增加了2.4 mol,这段时间内用氢气表示的反应速率为0.6mol /(L·s),则这段时间为
A.6 s B.4 s C.3 s D.2 s
难度: 简单查看答案及解析
-
假如你是某化工厂的总工程师,为了加快化学反应速率进而提高经济效益,你应优先考虑的措施是
A、选用适宜的催化剂 B、采用高压
C、采用高温 D、增大反应物的浓度
难度: 简单查看答案及解析
-
下列说法正确的是( )
A、化学反应中的能量变化都表现为热量的变化
B、吸热反应在不加热的条件一定不能发生
C、需要加热才能发生的反应一定是吸热反应,放热反应在常温下一定很容易发生
D、反应是吸热还是放热必须看旧键断裂时吸收的能量和新键生成时释放能量的大小
难度: 简单查看答案及解析
-
下列化学用语书写正确的是( )
A、氮气的电子式:
B、硫原子的结构示意图:
C、溴化钠的电子式:
D、水分子的结构式:
难度: 简单查看答案及解析
-
反应E+F=G在温度t1下进行,反应M+N=K在温度t2下进行,已知t1>t2,且E和F的浓度均大于M和N的浓度(其他条件均相同),则两者的反应速率
A.前者大 B.后者大 C.相等 D.无法判断
难度: 简单查看答案及解析
-
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,叙述正确的是
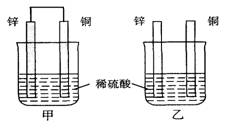
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.甲中铜被氧化,乙中锌被氧化
D.产生气泡的速率甲比乙快
难度: 简单查看答案及解析
-
下列分子含有的电子数目与HF相同,且只有两个极性共价键的是
A.CO2 B. H2O C.N2O D.CH4
难度: 简单查看答案及解析
-
两种微粒的质子数和电子数均分别相等,它们不可能是
A.一种阳离子和一种阴离子 B.一种单质和一种化合物分子
C.一种分子和一种离子 D.一种原子和一种分子
难度: 简单查看答案及解析
-
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的7/10,则下列说法中不正确的是

A.原子半径由大到小排列顺序Z>Y>X
B.Y元素的两种同素异形体在常温下都是气体
C.最高价氧化物对应水化物的酸性Z>W
D.阴离子半径由大到小排列顺序X>Y>Z>W
难度: 简单查看答案及解析
-
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由右图表示。在下列因素中对产生H2速率没有影响的是
A.H+的浓度 B.镁条的表面积 C.溶液的温度 D.Cl—的浓度
难度: 简单查看答案及解析
-
过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是
A.升高温度 B.加入适量的水
C.加入少量Na2SO4溶液 D.加入浓度较大的盐酸
难度: 简单查看答案及解析
-
向等质量的a、b两份锌粉中,分别加入过量的稀H2SO4,同时向a中加入少量的CuSO4溶液。下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是
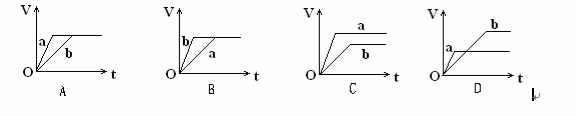
难度: 简单查看答案及解析
-
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是
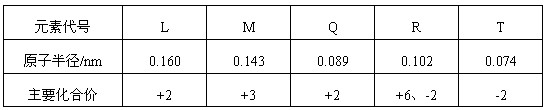
A.L2+与R2-的核外电子数相等
B.M与T形成的化合物具有两性
C.氢化物的稳定性为H2T<H2R
D.单质与浓度相等的稀盐酸反应的速率为Q<L
难度: 简单查看答案及解析
-
下列说法正确的是
A.第二周期元素从C到F,非金属性逐渐减弱
B.第三周期元素从Na到Cl,原子半径逐渐增大
C.HF、HCl、HBr、HI的热稳定性依次逐渐减弱
D.LiOH、NaOH、KOH的碱性依次逐渐减弱
难度: 简单查看答案及解析
-
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。下列说法正确的是
A.X的最高正价是+3
B.Y的氧化物是离子化合物
C.Z的氢化物的水溶液在空气中存放不易变质
D.X和Z的最高价氧化物对应的水化物都是强酸
难度: 简单查看答案及解析
-
某元素R的最高价氧化物的水化物分子式是HnRO2 n-2,则在气态氢化物中R元素的化合价是
A.3n-10 B.12-3n C.3n-4 D.3n-12
难度: 简单查看答案及解析
-
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应2A(g)+B(g)
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
① 用物质 A 表示的反应的平均速率为 0.3 mol·(L·s)-1
② 用物质 B 表示的反应的平均速率为 0.6 mol·(L·s)-1
③ 2 s 时物质 A 和 B 的转化率(发生反应的物质的量占总物质的量的百分数)一样
④ 2 s 时物质 B 的浓度为 0.3 mol·L-1
其中正确的是
A.①③ B.③④ C.②③ D.①④
难度: 简单查看答案及解析
-
人造地球卫星用到的一种高能电池——银锌蓄电池,其电池的电极反应式为Zn+2OH--2e-=ZnO+H2↑,Ag2O+H2O+2e-==2Ag+2OH-。据此判断氧化银是
A.负极,并被氧化 B.正极,并被还原
C.负极,并被还原 D.正极,并被氧化
难度: 简单查看答案及解析
-
下列分子中,所有原子都满足最外层为8电子结构的是
A.CO2 B.SiH4 C.SF6 D.PCl5
难度: 简单查看答案及解析
-
下列叙述正确的是
A.非金属原子间以共价键结合的物质都是共价化合物
B.含有共价键的化合物都是共价化合物
C.凡是能电离出离子的化合物都是离子化合物
D.凡是含有离子键的化合物都是离子化合物
难度: 简单查看答案及解析
-
下列说法正确的是
A.Li是最活泼金属,F是最活泼非金属
B.Mg(OH)2碱性比Ca(OH)2强
C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
D.X2+的核外电子数目为18,则X在第四周期第ⅡA族
难度: 简单查看答案及解析
-
aXn-和bYm+为两主族元素的离子, 它们的电子层结构相同, 下列判断错误的是
A.原子半径X<Y B.a+n=b-m
C.Y最高价氧化物的化学式为YOm D.X的氢化物的化学式为HnX
难度: 简单查看答案及解析
-
在一定温度下,反应A2(g)+B2(g)
2AB(g)达到反应限度的标志是
A、容器内气体的总压强不随时间变化而变化
B、A2、B2和AB的物质的量不再改变
C、c(A2):c(B2):c(AB)===1:1:2
D、A2和B2的物质的量之和与AB的物质的量相等
难度: 简单查看答案及解析
-
北京奥运会开幕式在李宁点燃鸟巢主火炬时达到高潮。奥运火炬采用的是环保型燃料——丙烷,其燃烧时发生反应的化学方程式为C3H8+5O2
3CO2+4H2O。下列说法中不正确的是
A、火炬燃烧时化学能只转化为热能
B、所有的燃烧反应都会释放热量
C、1 mol C3H8和5 mol O2所具有的总能量大于3 mol CO2和4 mol H2O所具有的总能量
D、丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料
难度: 简单查看答案及解析