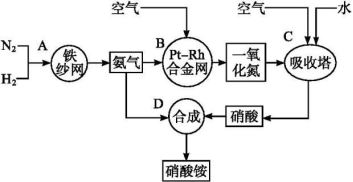
-
为纪念编制元素周期表的俄国化学家,人们把第101号元素(人工合成元素)命名为钔(元素符号为Md),这位科学家是( )
A.拉瓦锡 B.波尔 C.道尔顿 D.门捷列夫
难度: 简单查看答案及解析
-
下列各组物质中互称为同分异构体的是( )
A.红磷与白磷
B.水与重水
C.乙醇(CH3CH2OH)与二甲醚(CH3OCH3)
D.O2与O3
难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A.共价化合物中一定只含共价键
B.碳酸氢铵是典型离子化合物,其受热分解产生氨气不仅破坏离子键还破坏了共价键
C.化学反应是吸热还是放热必须看反应物和生成物所具有的总能量的相对大小
D.干冰变为二氧化碳气体,需吸收能量,是因为共价键被破坏
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.S2-的结构示意图是
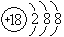
B. HCl 的电子式为H+[:Cl:]-
C.H2O的结构式为H—O—H
D.还原性:HCl>H2S
难度: 中等查看答案及解析
-
对下列事实的解释正确的是( )
A.浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定
B.不用浓硝酸与铜屑反应来制取硝酸铜,说明浓硝酸具有挥发性
C.足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化Fe2+
D.锌与稀硝酸反应得不到氢气,说明稀硝酸能使锌钝化
难度: 中等查看答案及解析
-
铜粉放入稀硫酸溶液中,加热后无明显现象发生。当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出。该盐是( )
A.Fe2(SO4)3 B.Na2CO3 C.KNO3 D.FeSO4
难度: 中等查看答案及解析
-
电子表和电子计算器的电源通常用微型银-锌电池,其电极分别为Ag2O 和Zn,电解质为KOH溶液,电极总反应为:Ag2O + H2O + Zn = Zn(OH)2 + 2Ag.下列叙述不正确的是( )
A.工作时Zn 电极质量减少
B.Zn 是负极, Ag2O 是正极
C.工作时溶液中电子由Ag2O 流向Zn
D.溶液中氢氧根离子向Zn 电极移动
难度: 中等查看答案及解析
-
在人体所需的十多种微量元素中,有一种称为生命元素的R 元素,对延长人类的寿命起着重要的作用。已知R元素的原子有四个电子层,其最高价氧化物的分子式为RO3,则R元素的名称为( )
A.硫 B.砷 C.硒 D.硅
难度: 中等查看答案及解析
-
下列各组物质中,按熔点由低到高排列正确的是( )
A.CO2<KCl<SiO2 B.O2<I2<Br2
C.H2O<H2S<HCl D.SiC<NaCl<SO2
难度: 中等查看答案及解析
-
下列物质属于离子晶体的是( )
A.熔点是1070℃,固态不导电,熔融状态能导电,易溶于水
B.熔点是10.31℃,液态不导电,水溶液能导电
C.熔点3550℃,不溶于水,不导电
D.熔点是97.80℃,质软,固态可导电,密度是0.97g·cm-3
难度: 中等查看答案及解析
-
下列事实能判断金属元素甲的金属性一定比乙强的有( )
①甲单质能与乙盐的溶液反应②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙④甲、乙两元素的单质和盐酸组成原电池,乙单质表面生成氢气⑤两单质分别与氯气反应时生成的阳离子,甲失去的电子数比乙多
A. 全部可以 B. 仅②不可以 C. 仅②⑤不可以 D. ③④可以
难度: 中等查看答案及解析
-
下表中列出了有关晶体的说明,有错误的是( )
选项
A
B
C
D
晶体名称
碘化钾
干冰
硫
碘
晶体中的微粒名称
阴、阳离子
分子
原子
分子
晶体内存在的结合力
离子键
范德华力
共价键
范德华力
难度: 中等查看答案及解析
-
如下图的装置能构成原电池并产生电流的是( )
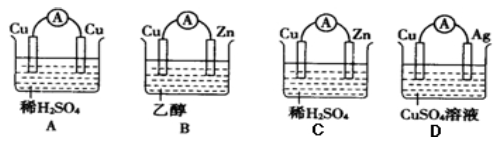
难度: 中等查看答案及解析
-
X、Y两根金属棒插入Z溶液中构成如下图的装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是下列中的( )
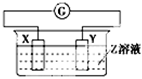
编号
X
Y
Z
A
Zn
Cu
稀硫酸
B
Cu
Zn
稀硫酸
C
Cu
Ag
硫酸铜溶液
D
Ag
Zn
硝酸银溶液
难度: 中等查看答案及解析
-
W是由短周期元素X、Y、Z组成的盐。X、Y、Z原子的最外层电子数依次增大,Z原子最外层电子数是内层电子数的3倍;X、Y原子最外层电子数之和等于Z原子的最外层电子数;Y、Z同周期且相邻,但与X 不同周期。下列说法一定正确的是( )
A.三种元素的最高正化合价中,Z的最大 B.X、Y、Z不能形成共价化合物
C.原子半径:X>Y>Z D.Y的最高价氧化物对应的水化物是强酸
难度: 中等查看答案及解析
-
右图表示在某温度下经时间t反应后,物质x、y、z、w的物质的量的变化情况。则所发生反应的化学方程式是( )
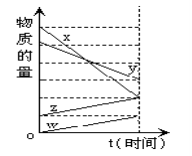
A. 4x+2y=z+w B. 6x+5y=4z+w
C. 3w+z=4x+2y D. 2x+y=2z+2w
难度: 中等查看答案及解析
-
反应2A=B+3C,在20℃进行时其vA=5mol·L-1·s-1。已知温度每升高10℃,此反应速率增大到原来的2倍,则当其它条件不变时,温度升高至50℃时,此反应中vC 是( )
A.20mol·L-1·s-1 B.40mol·L-1·s-1
C.60mol·L-1·s-1 D.15mol·L-1·s-1
难度: 中等查看答案及解析
-
下列各组化合物的性质比较,不正确的是( )
A.非金属性:F>O>S B.稳定性:PH3>H2S>HCl
C.碱性:NaOH>Mg(OH)2>Al(OH)3 D.酸性:HClO4>HBrO4>HIO4
难度: 中等查看答案及解析
-
右图中每条折线表示周期表ⅣA~ⅦA中某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是( )
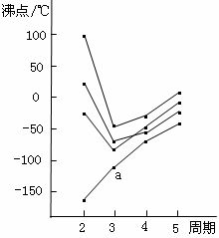
A.H2S B.HCl C.PH3 D.SiH4
难度: 中等查看答案及解析
-
把下列四种溶液分别加入四个盛有10mL 2mol·L-1盐酸的烧杯中,均加水稀释到50mL,此时X和盐酸缓慢反应,其中反应最快的是( )
A.10℃15mL、3mol·L-1的X溶液 B.10℃30mL、1mol·L-1 的X溶液
C.10℃30mL、2 mol·L-1 的X溶液 D.10℃10mL、4mol·L-1 的X溶液
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的2倍,下列说法中正确的是( )
X
Y
Z
W
A.单质的熔点:X>Y
B.最高价氧化物对应的水化物的酸性:W>Y
C.4种元素的单质中,W单质的熔、沸点最高
D.干燥的W单质具有漂白性
难度: 中等查看答案及解析
-
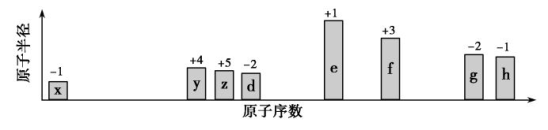
短周期元素X、Y、Z、W、R的化合价与原子序数的关系如图所示,下列说法正确的是( )
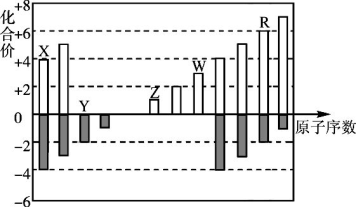
A.原子半径:Z>Y>X
B.气态氢化物稳定性:Y<R
C.Z和Y形成的化合物是离子化合物
D.常温下单质W 能溶于R的最高价氧化物对应水化物的浓溶液。
难度: 中等查看答案及解析
-
可逆反应:2NO2(g)
2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2表示的反应速率的比为2∶2∶1 的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
难度: 中等查看答案及解析
-
下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量B跟Cl2反应除生成C外,另一产物是盐酸盐。
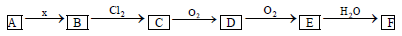
下列说法不正确的是( )
A.当X是强酸时,A、B、C、D、E、F均含同一种元素,F是H2SO4
B.当X是强碱时,A、B、C、D、E、F均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C常温下是气态单质
难度: 中等查看答案及解析
-
1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4 的混合气体1120mL(标准状况),向反应后的溶液中加入1.0 mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54g沉淀时,加入NaOH溶液的体积是600mL
难度: 中等查看答案及解析