-
NA为阿伏加德罗常数的数值,下列说法中正确的是( )
A.NA个Fe(OH)3胶体粒子的质量为107g
B.常温常压下,7.0g乙烯与丁烯的混合物中含有氢原予的数目为NA
C.在密闭容器中加入1.5 mol H2和0.5molN2,在一定条件下充分反应后可得到NH3分子数为NA
D.标准状况下,11.2L C2H6含3NA个C-H非极性共价键难度: 中等查看答案及解析
-
仅用下表提供的玻璃仪器(非玻璃仪器任选)就能实现相应实验目的是( )
选项 实验目的 玻璃容器 A 分离乙醇和乙酸乙酯的混合物 分液漏斗、烧杯 B 用pH=l的盐酸配置l00mL pH=2
的盐酸100mL容量瓶、烧杯、玻璃棒、胶头滴管 C 用溴水、淀粉-KI溶液比较Br2与I2
的氧化性强弱试管、胶头滴管 D 用NH4Cl固体和Ca(OH)2固体制
备并收集NH3酒精灯、烧杯、导管、集气瓶
A.选项A
B.选项B
C.选项C
D.选项D难度: 中等查看答案及解析
-
下列说法正确的( )
A.淀粉、油脂、蛋白质都能水解,但水解产物不同
B.按系统命名法,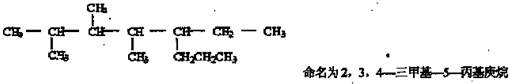
C.用溴水可以鉴别己烯、甲苯、苯酚、己烷和乙醇
D.苯乙烯分子中所有原子不可能在同一个平而上难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中定能大量共存的是( )
A.水电离的H+浓度为1×10-10mol/L,的溶液中:Al02-、SiO32-、K+、Na+
B.Kw/c(H+)=0.lmol/L的溶液中:Na+、SiO32-、I-、CO32-
C.pH=l的溶液中:NH4+、Na+、SO42-、C17H35COO-
D.0.lmol/L的NaHSO4溶液中K+、Fe2+、Cl-、NO3-难度: 中等查看答案及解析
-
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图的是( )
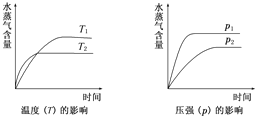
A.CO2(g)+2NH3(g)⇌CO(NH2)2(s)+H2O(g);△H<0
B.CO2(g)+H2(g)⇌CO(g)+H2O(g);△H>0
C.CH3CH20H(g)⇌CH2=CH2(g)+H2O(g);△H>0
D.2C6H5CH2CH3(g)+O2(g)⇌2C6H5CH=CH2(g)+2H2O(g);△H<0难度: 中等查看答案及解析
-
电导率可用于衡量电解质溶液导电能力大小.室温下,用0.l00mol/LNH3•H2O滴定10.00mL浓度均为0.100mol/L HC1和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )
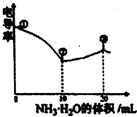
A.①点溶液中C(H+)为0.200 mol/L
B.溶液温度在①时最高
C.③点溶液中有c(C1-)>c(CH3COO-)
D.③点后因离子数目减,少使溶液电导率略降低难度: 中等查看答案及解析
-
取一定质量的均匀固体混合物Cu、Cu2O和CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少,6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为( )
A.3.2mol.L-1
B.3.6moI.L-1
C.4.0mo1•L-1
D.无法判断难度: 中等查看答案及解析