-
化学与生产、生活、环境密切相关。下列说法错误的是
A.航天飞机上的隔热陶瓷瓦属于复合材料
B.水泥、陶瓷均为硅酸盐产品
C.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关
D.化学反应能够制造出新的物质,同时也能制造出新的元素
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.1H、D+、T2互为同位素
B.H2O、CH3COOH、NH4HCO3都是电解质
C.铝、铁、铜三者对应的氧化物均为碱性氧化物
D.有单质参加的反应一定是氧化还原反应
难度: 中等查看答案及解析
-
下列离子方程式的书写正确的是
A.氢氧化钡和稀硫酸反应:Ba2++OH-+H++SO42-===BaSO4↓+H2O
B.铜片跟稀硝酸反应:Cu+NO3-+4H+===Cu2++NO↑+2H2O
C.醋酸除去水垢中的CaCO3:CaCO3+2H+===Ca2++H2O+CO2↑
D.硫酸亚铁溶液与过氧化氢溶液混合:2Fe2++H2O2+2H+===2Fe3++2H2O
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,下列有关说法中不正确的是
A.标准状况下,22.4 L氦气含有NA个氦原子
B.20 g重水含有10 NA个电子
C.12.5 mL l6 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2 NA
D.1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1 NA
难度: 中等查看答案及解析
-
关于原子结构、元素性质的说法正确的是
A.随原子序数的递增,元素原子的核外电子数逐渐增多,原子半径逐渐减小
B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素
C.若两种元素原子的最外层电子数相同,则元素最高正价一定相同
D.电子层结构相同的微粒,其化学性质一定相似
难度: 中等查看答案及解析
-
下列说法正确的是
A.泥沙和水的混合物可用分液漏斗分离
B.测溶液pH值:将一小块pH试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照
C.用丁达尔现象可区分氢氧化铁胶体和氯化铁溶液
D.氢氧化钠溶液保存在带有玻璃塞的试剂瓶中
难度: 中等查看答案及解析
-
下列推断合理的是
A.Fe3+、O2、H2O2三种微粒都具有氧化性,没有还原性
B.木炭与浓硝酸反应可能生成CO和NH4NO3
C.因为SO2具有还原性,所以不能用浓H2SO4干燥SO2
D.Cl2转变为HClO时一定需要加入氧化剂才能实现
难度: 中等查看答案及解析
-
下列各组物质的性质比较中不正确的是
A.氧化性:F2>C12>Br2
B.酸性:HClO4>H2SO4>H3PO4
C.碱性:NaOH>Mg(OH)2>Al(OH)3
D.热稳定性:SiH4>PH3>H2S
难度: 中等查看答案及解析
-
已知:①Na3N+3H2O===3NaOH+NH3↑,②NaH+H2O===NaOH+H2↑下列叙述正确的是
A.离子半径:N3->Na+>H+
B.反应①和②都是氧化还原反应
C.反应①和②氧化剂都是H2O
D.Na3N和NaH与盐酸反应都只生成一种盐
难度: 中等查看答案及解析
-
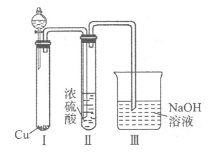
用下列装置进行相应实验,能达到实验目的的是
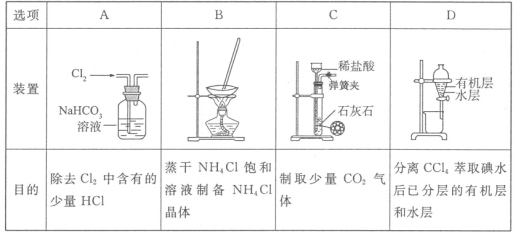
难度: 中等查看答案及解析
-
下列有关物质的性质及应用说法正确的是
A.Si具有导电性,可用作半导体材料
B.难熔的Al2O3制成的坩埚,可用于熔融烧碱
C.氯气具有酸性,可与烧碱或石灰乳反应制备含氯消毒剂
D.Cl2和SO2均有漂白性,均可使含有酚酞的NaOH溶液褪色
难度: 中等查看答案及解析
-
有关粒子在相应条件下能大量共存的是
A.常温常压下混合气体:H2、F2、NO、O2
B.能溶解Al2O3的溶液:NH+、K+、Cl-、CO32-
C.c(H+)=1.0 mol·L-1的溶液中:K+、Fe3+、SO42-、I-
D.澄清透明的溶液中:Na+、K+、MnO4-、[Al(OH)4]-
难度: 中等查看答案及解析
-
下列各图所示装置的气密性检查中,漏气的是
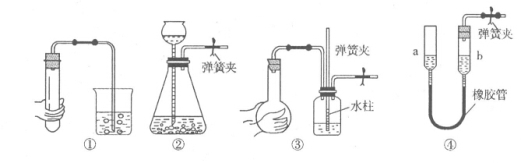
A.对装置①,双手移去后,导管中水面高于烧杯内水面
B.对装置②,长颈漏斗内液面高度保持不变
C.对装置③,长导管内形成一段水柱
D.对装置④,上下移动a管后,a、b两端液面仍相平
难度: 中等查看答案及解析
-
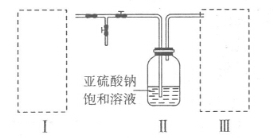
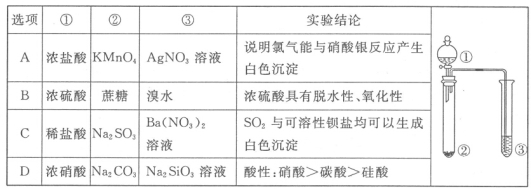
利用右图所示装置进行下列实验,能得出相应实验结论的是
难度: 中等查看答案及解析
-
剧毒的氰化物可与碱发生反应2CN-+8OH-+5C12===2CO2+N2+10C1-+4H2O下列判断正确的是
A.当有0.2 mol CO2生成时,溶液中阴离子的物质的量增加l mol
B.该反应中,每有2mol CN-反应,转移电子为10 mol
C.上述反应中的还原剂是OH-
D.还原性:Cl->CN-
难度: 中等查看答案及解析