-
生活中的一些问题常涉及到化学知识,则下列叙述不正确的是
A.高温能杀死流感病毒是因为构成病毒的蛋白质受热变性
B.明矾和漂白粉常用于自来水的处理,但两者的作用原理不相同
C.氯化铁溶液可用于制作印刷电路板是因为其具有较强氧化性,能氧化单质铜
D.“加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是对应的单质分子,而钙、铁则指的是对应的钙离子和铁离子
难度: 中等查看答案及解析
-
下列物质中,属于弱电解质的是
A.氯化氢 B.碳酸氢钠 C.一水合氨 D.二氧化硫
难度: 简单查看答案及解析
-
下列说法正确的是
A.盐溶液都是中性的
B.盐溶液的酸碱性与盐的类型无关
C.碳酸钠溶液显碱性,是因为溶液中c(OH-)>c(H+)
D.NaHCO3溶液显酸性
难度: 中等查看答案及解析
-
将用润湿的pH试纸,去测定某溶液的pH,该测得的pH将会
A.偏高 B.偏低
C.不变 D.上述三种情况均有可能
难度: 中等查看答案及解析
-
下列离子方程式中,属于水解反应的是
A.HCOOH+H2O
HCOO-+H3O+
B.CO2+H2O
H2CO3
C.CO32-+H2O
HCO3-+OH-
D.HCO3-+H2O
CO32- +H3O+
难度: 中等查看答案及解析
-
下列物质加入水中,能使水的电离度增大,溶液的pH值减小的是
A、HCl B、Al2(SO4)3 C、Na2CO3 D.NH3·H2O
难度: 中等查看答案及解析
-
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中不正确的是
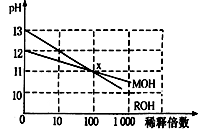
A.ROH是一种强碱
B.在x点,MOH未完全电离
C.在x点,c(M+)=c(R+)
D.稀释前,c(ROH)=10c(MOH)
难度: 中等查看答案及解析
-
有关AgCl沉淀的溶解平衡说法正确的是
A.此时,AgCl沉淀溶解速率为零
B.AgCl难溶于水,溶液中没有Ag+ 和Cl—
C.升高温度,AgCl沉淀的溶解度增大
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变
难度: 简单查看答案及解析
-
25℃时,弱酸的电离平衡常数如表所示,下列说法正确的是
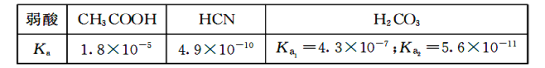
A.物质的量浓度相等的三种溶液中,pH大小关系为:pH(NaCN)> pH(Na2 CO3 )pH(CH3 COONa)
B.amol·L-1 HCN与b mol·L-1 NaOH溶液等体积混合所得的溶液中c(Na+)>c(CN-),则a一定小于b
C.向冰醋酸中逐滴加水稀释的过程中,溶液导电能力先增大,后减小
D.将0.1 mol·L-1的Na2 CO3溶液逐滴加入到等浓度的HCN溶液中,无明显现象,说明未反应
难度: 困难查看答案及解析
-
下列实验装置设计正确、且能达到目的的是
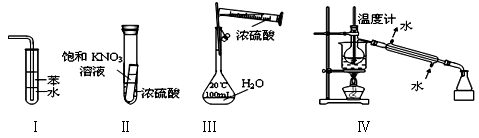
A.实验I:可用于吸收氨气,并能防止倒吸
B.实验Ⅱ:静置一段时间,小试管内有晶体析出
C.实验III:配制一定物质的量浓度的稀硫酸
D.实验Ⅳ:海水的淡化
难度: 中等查看答案及解析
-
室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
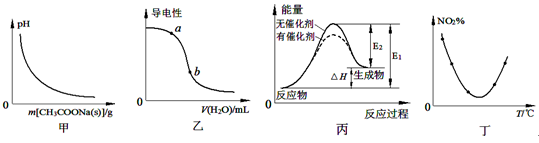
A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C.图丙表示催化剂能改变化学反应的焓变
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
难度: 中等查看答案及解析
-
若溶液中由水电离的c(OH-)=1×10-14mol/L,则在此溶液中一定不能大量共存的离子组是
A.Al3+ Na+ NO3- Cl- B.K+ Na+ Cl- NO3-
C.K+ Na+ SO32- NO3- D.K+ NH4+ SO42- HCO3
难度: 中等查看答案及解析
-
大气中的SO2是造成酸雨的主要污染物。最新研究表明,离子晶体[N(CH3)4]2 SO4(s) 能与SO2进行如下可逆反应,使其可能成为绿色的SO2吸收剂:[N(CH3)4]2 SO4(s)+ SO2(g)
[N(CH3)4]2 S2O6(s)下列说法正确的是
A.[N(CH3)4]+中只含共价键
B.该反应中,SO2作氧化剂
C.SO2漂白品红是利用其强氧化性
D.每吸收标准状况下的SO211.2L,生成15.4g[N(CH3)4]2 S2O6
难度: 中等查看答案及解析
-
下图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是①Fe;②HNO3;③Na;④C

A.①②③ B.②③④ C.①②④ D.①②③④
难度: 中等查看答案及解析
-
如图是常见四种有机物的比例模型示意图。下列说法正确的是
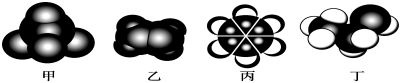
A.甲在一定条件下与氯气混合反应,产物共四种
B.乙可与溴水发生取代反应使溴水褪色
C.丙在一定条件下可与硝酸发生取代反应
D.丁在稀硫酸作用下可与氧气发生催化氧化反应
难度: 中等查看答案及解析
-
下列解释物质用途的反应方程式不正确的是
A.用Fe2(SO4)3净水 Fe3+ +3H2O
Fe(OH)3 +3H+
B.用Na2S处理含Hg2+废水 Hg2+ +S2-=HgS↓
C.用Na2CO3溶液处理水垢中的CaSO4 Ca2+ +CO32- =CaCO3↓
D.燃煤时加入石灰石,减少SO2排放 2CaCO3+2SO2 +O2
2CaSO4 +2CO2
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.向FeCl3溶液中加入Mg(OH)2: 3Mg(OH)2+2Fe3+ == 2Fe(OH)3 +3 Mg2+
B.草酸使酸性KMnO4溶液褪色:

C.往NaHS04溶液中滴加Ba(OH)2至溶液呈中性:
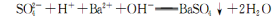
D.向NaCl0溶液中通人少量的CO2:CO2 +2C1O-+H2O == CO32-+ 2 HC1O已知Ka1(H2 CO3)>Ka( HC1O)>Ka2(H2 CO3)
难度: 困难查看答案及解析
-
五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)。下列说法正确的是
元素代号
X
W
Y
Z
Q
原子半径(×10-12 m)
37
64
66
70
154
主要化合价
+1
-1
-2
+5、-3
+1
A.由Q与Y形成的化合物中只存在离子键
B.Z与X之间形成的化合物具有还原性
C.由X、Y、Z三种元素形成的化合物,一定是共价分子
D.Y与W形成的化合物中,Y显负价
难度: 中等查看答案及解析
-
下述实验不能达到预期目的的是
选项
实验目的
实验方案
A
验证Ksp(AgCl)>Ksp(AgI)
向NaCl溶液中滴加少量AgNO3溶液,产生白色沉淀,再滴加KI溶液,可观察到白色沉淀转化为黄色沉淀
B
检验Fe(NO3)2晶体是否已氧化变质
将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红
C
验证Br2的氧化性强于I2
将少量溴水加入KI溶液中,再加入CCl4,振荡,静置。可观察到下层液体呈紫色
D
比较确定铜和镁的金属活动性强弱
用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液
难度: 中等查看答案及解析
-
TESLA电动汽车的电池采用了松下提供的NCA系列(镍钴铝体系)的18650A型钴酸锂(LiCoO2)锂离子电池。电池正极材料为钴酸锂(LiCoO2),负极材料是石墨(C6)。电池反应为: LiCoO2+C6
C6Lix+Li1-xCoO2。下列有关说法不正确的是
A.锂离子电池与传统铅蓄电池相比,具有高比能量(比能量指的是单位重量或单位体积的能量)的特点
B.废旧锂离子电池先进行“放电处理”让Li+进入石墨(C6)中而利于回收
C.放电时,正极锂的化合价未发生改变
D.充电时电池正极上发生的反应为:LiCoO2—x e-=== Li1-x CoO2+xLi+
难度: 困难查看答案及解析
-
下列实验操作与预期实验目的或所得实验结论一致的是
选项
实验操作
实验目的或结论
A
将NaOH溶液滴入该溶液中加热,放出的气体能使湿润的红色石蕊试纸变蓝
证明溶液中有NH4+
B
向某溶液中加入稀盐酸,放出无色刺激性气味气体,将气体通入澄清石灰水,石灰水变浑浊
证明该溶液中存在SO32-
C
将Cl2通入品红溶液中,品红溶液褪色
证明Cl2的还原性
D
用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色
证明氧化性:H2O2比Fe3+强
难度: 中等查看答案及解析

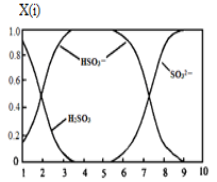
 (2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。