-
化学与资源、环境、生活关系密切相关,下列说法正确的是
A. 煤燃烧时加入少量生石灰的目的是减少废气中的二氧化碳排放
B. 空气中PM2.5(2.5微米以下的颗粒物)的存在可能形成丁达尔效应
C. 葡萄糖、蔗糖、油脂和蛋白质等营养物质在人体吸收后都能被水解
D. 在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮、氧化变质
难度: 简单查看答案及解析
-
用NA表示阿伏伽德罗常数的值。下列叙述正确的是
A. 1mol羟基与1mol氢氧根离子所含有的电子数目均为9NA
B. 电解饱和食盐水,当阴极产生2.24L气体时,转移的电子数为0.2NA
C. 7.8gNa2O2和Na2S的混合物中含有的离子总数为0.7NA
D. 常温下,1L0.1mol/LNa2CO3溶液中,含有离子的总数大于0.3NA
难度: 中等查看答案及解析
-
下列说法正确的是
A. 丙烯分子中所有原子有可能在同一平面上
B. 乙醇、乙酸和苯可用溴水区分
C. 分子式为C4H8O2并能与乙醇发生酯化反应生成的有机物有2种
D. 苯的硝化反应、乙醇和氧气制乙醛属于同一类反应类型
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、R的原子序数依次增大,Y原子达到稳定结构获得的电子数目和它的内层电子数目相等,X与Z同主族,Z是所在周期主族元素中原子半径最大的元素,W的最外层电子数与电子层数相同,R与Z形成的化合物其水溶液呈碱性。下列说法正确的是
A. 离子半径由大到小的顺序为R、Z、Y、W
B. X、Y分别与Z形成的多种化合物中化学键类型相同
C. Y、R分别与X形成的化合物沸点依次升高
D. Z、W、R最高价氧化物对应的水化物两两之间均能发生反应
难度: 中等查看答案及解析
-
用下图所示装置进行下列实验,a、b和c中所装试剂如下表所示,其中实验现象与结论对应关系正确的一组是
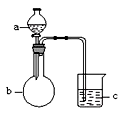
选项
a
b
c
现象
结论
A
饱和食盐水
碳化钙
溴水
c中溶液黄色褪去
乙炔发生还原反应
B
浓盐酸
KMnO4固体
NaBr溶液
c中溶液由无色变橙色
Cl2的氧化性比Br2强
C
稀盐酸
大理石
Na2SiO3溶液
c中有白色胶状沉淀生成
碳酸的酸性比硅酸强
D
硫酸
Na2SO3固体
酸性KMnO4溶液
c中溶液紫色褪去
SO2具有漂白性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关溶液的叙述错误的是
A. pH相同的①CH3COONa、②NaHCO3、③NaAlO2溶液中c(Na+):③>②>①
B. 将0.2mol·L-1NaHCO3溶液与0.1mol·L-1KOH溶液等体积混合:3c(K+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
C. 常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同
D. 向AgCl和AgBr的等体积饱和溶液中加入足量AgNO3溶液,则AgCl沉淀多于AgBr沉淀
难度: 困难查看答案及解析
-
某模拟“人工树叶”的电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法错误的是
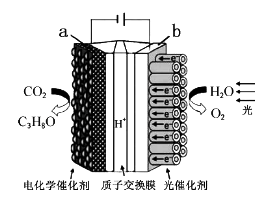
A. 该装置工作时,H+从b极区向a极区迁移
B. 每生成1molO2,有44gCO2被还原
C. a电极的反应式为3CO2+18H++18e-=C3H8O+5H2O
D. C3H8O和O2形成燃料电池以氢氧化钠作为电解质溶液的负极反应式:C3H8O-18e-+24OH-=3CO32-+16H2O
难度: 中等查看答案及解析



 与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定浓度后氯化亚铜的沉淀率减少,原因是________。
与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定浓度后氯化亚铜的沉淀率减少,原因是________。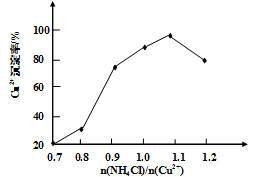
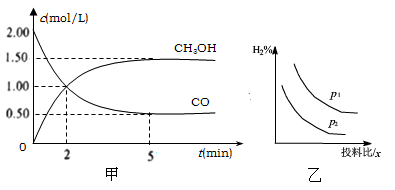
 其中碳原子采取sp2杂化的分子有
其中碳原子采取sp2杂化的分子有

