-
在下图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰。H可用于制造光导纤维,J是一种乳白色凝胶状沉淀。(部分生成物和部分反应条件未列出)

请回答下列问题:
(1)A的电子式为 ________
形成单质D的元素在周期表中的位置________
(2)形成C、D、F单质的元素半径由大到小的顺序(填写元素符号) ________
(3)C长期暴露在空气中,最终产物是________
(4)H的化学式为________H在高温下与碳反应,若转移4mol电子参加反应的碳为________mol。
(5)写出反应①的离子方程式________
(6)写出反应②的化学方程式________
-
I.已知有机物A仅含碳、氢、氧3种元素,质谱分析可知其相对分子质量为46,核磁共振氢谱显示分子中有三种不同化学环境的氢原子,且有如下的转化关系:
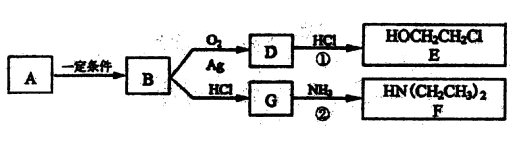
(1)由A→B的化学反应方程式是,反应类型是________反应。
(2)D的红外光谱表明分子内除C-H键、C-C键外还含有两个C—O单键,反应①中D与HCl按物质的量之比1:1反应,则D的结构简式是________
由E制备乙二醇需要加入的试剂是________
Ⅱ.化合物E和F是药品普鲁卡因合成的重要原科,普鲁卡因的合成路线如下(已知 ):
):

(4)乙的含氧官能团名称为________、________
(5)丁的结构简式为
(6)反应③的化学方程式是________
(7)普鲁卡因有两种水解产物戊和己,且戊与甲具有相同的分子式。写出任意3种符合下列条件的戊的同分异构体________(不包含戊);
a.分子结构中含苯环,且每个苯环有2个侧链
b.分子结构中一定含官能团—NH2且—NH2直接与碳原子相连
(8)戊经聚合反应制成的高分子纤维广泛用于通讯、宇航等领域。该聚合反应的化学方程式是________。
-
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验I:制取NaClO2晶体
己知:NaClO2饱和溶液在温度低于38℃时析出品体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置进行实验。
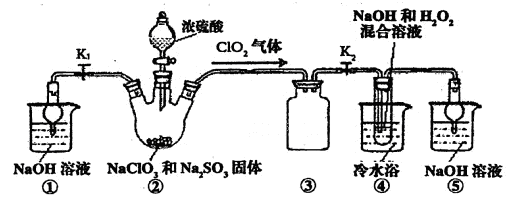
(1)装置③的作用是________
装置①的作用是________
(2)装置②中产生ClO2的还原剂是
装置④中制备ClO2的化学方程式为________
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶:②趁热过滤;③________;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品小打烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为________
(5)该样品中NaClO2的质量分数为________(用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为________ 。
-
尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1
下列措施中有利于提高尿素的生成速率的是________
A.采用高温
B.采用高压
C.寻找更高效的催化剂
D.减小体系内CO2浓度
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)  H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4(l)  H2O(l)+H2NCONH2(l) △H2.
H2O(l)+H2NCONH2(l) △H2.
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和l mol二氧化碳,实验测得反应中各组分随时间的变化如下图I所示:
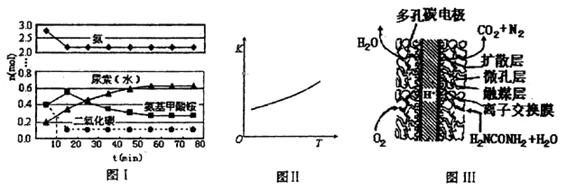
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第________步反应决定,总反应进行到________min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上图II所示,则△H2 ________0(填“>” “<” 或 “=”)
(3)在温度70-95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2
①尿素与NO、NO2三者等物质的量反应,化学方程式为
________
②已知:N2(g)+O2(g)=2NO(g).△H=180.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol-1
则4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g) △H=________kJ·mol-1
(4)尿素燃料电池结构如上图III所示。其工作时负极电极反应式
可表示为________ 。


 ):
):

