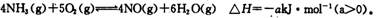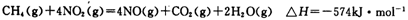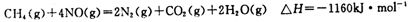-
尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位.
(1)工业上合成尿素的反应如下:2NH3(l)+CO2(g)⇌H2O(l)+H2NCONH2(l)△H=-103.7kJ•mol-1
下列措施中有利于提高尿素的生成速率的是______
A.采用高温 B.采用高压
C.寻找更高效的催化剂 D.减小体系内CO2浓度
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)⇌H2NCOONH4(氨基甲酸铵)(l)△H1
第二步:H2NCOONH4(l)⇌H2O(l)+H2NCONH2(l)△H2.
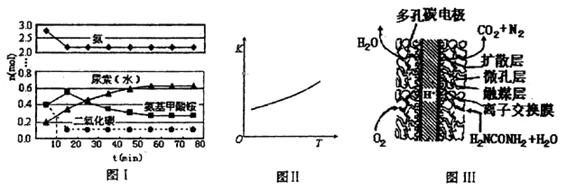
某实验小组模拟工业上合成尿素的条件,在一体积为0.5L密闭容器中投入4mol氨和l mol二氧化碳,实验测得反应中各组分随时间的变化如下图I所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第______步反应决定,总反应进行到______min时到达平衡.
②第二步反应的平衡常数K随温度的变化如上图II所示,则△H2______0(填“>”“<”或“=”)
(3)在温度70-95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2
①尿素与NO、NO2三者等物质的量反应,化学方程式为______.
②已知:N2(g)+O2(g)═2NO(g).△H=180.6kJ•mol-1
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=______kJ•mol-1
(4)尿素燃料电池结构如上图III所示.其工作时负极电极反应式可表示为______.
-
尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1
下列措施中有利于提高尿素的生成速率的是________
A.采用高温
B.采用高压
C.寻找更高效的催化剂
D.减小体系内CO2浓度
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)  H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4(l)  H2O(l)+H2NCONH2(l) △H2.
H2O(l)+H2NCONH2(l) △H2.
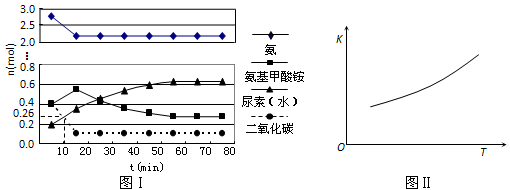
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和l mol二氧化碳,实验测得反应中各组分随时间的变化如下图I所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第________步反应决定,总反应进行到________min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上图II所示,则△H2 ________0(填“>” “<” 或 “=”)
(3)在温度70-95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2
①尿素与NO、NO2三者等物质的量反应,化学方程式为
________
②已知:N2(g)+O2(g)=2NO(g).△H=180.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol-1
则4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g) △H=________kJ·mol-1
(4)尿素燃料电池结构如上图III所示。其工作时负极电极反应式
可表示为________ 。
-
(15分)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g)  H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
试回答下列问题:
⑴下列措施中有利于提高尿素的产率的是___________。
A.采用高温
B.采用高压
C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)  H2NCOONH4(氨基甲酸铵) (l) △H1
H2NCOONH4(氨基甲酸铵) (l) △H1
第二步:H2NCOONH4(l)  H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_____步反应决定,总反应进行到_________min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_______________________。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2__________0(填“>”“<”或“=”)
-
(15分)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
试回答下列问题:
⑴下列措施中有利于提高尿素的产率的是___________。
A.采用高温
B.采用高压
C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1
H2NCOONH4(氨基甲酸铵) (l) △H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_____步反应决定,总反应进行到_________min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_______________________。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2__________0(填“>”“<”或“=”)
-
(8分)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
试回答下列问题:
(1)下列措施中有利于提高尿素的产率的是▲ 。
A.采用高温 B.采用高压 C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1
H2NCOONH4(氨基甲酸铵) (l) △H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,


图Ⅰ 图Ⅱ
实验测得反应中各组分随时间的变化如下图Ⅰ所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第▲ 步反应决定,总反应进行到▲ min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=▲ 。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2▲ 0(填“>”“<”或“=”)
-
尿素(H2NCONH2)是有机态氮肥,在农业生产中有着非常重要的作用。
(1)工业上合成尿素的反应分两步进行:
第一步:2NH3(l)+CO2 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4 (l)  H2O+ H2NCONH2(l) △H2
H2O+ H2NCONH2(l) △H2
某化学学习小组模拟工业上合成尿素的条件,在体积为1 L的密闭容器中投入4 mol NH3和1 mol CO2,实验测得反应中各组分的物质的量随时间的变化如下图I所示。

①已知总反应的快慢是由较慢的一步反应决定的。则合成尿素总反应的快慢由第______步反应决定,总反应进行到______min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上右图II所示,则ΔH2______0(填“>”、“<”或“=”。)
(2)该小组将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变, 固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/Kpa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①可以判断该分解反应已经达到化学平衡状态的标志是____________。
A.2V(NH3)=V(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0°C时该分解反应的平衡常数为______(保留小数点后一位)。
(3)已知:
N2(g)+O2(g)=2NO(g) △H1=+180.6KJ/mol
N2(g)+3H2(g)=2NH3(g) △H2=-92.4KJ/mol
2H2(g)+O2(g)=2H2O(g) △H3=-483.6KJ/mol
则4NO(g)+4NH3(g) +O2(g)= 4N2(g)+6 H2O(g)的△H=___kJ • mol-1。
(4)尿素燃料电池的结构如图所示。其工作时 负极电极反应式可表示为______。

-
(16分)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应分为如下两步:
第1步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1= —330.0 kJ·mol-1
H2NCOONH4(氨基甲酸铵) (l) △H1= —330.0 kJ·mol-1
第2步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2=+226.3 kJ·mol-1
H2O(l)+H2NCONH2(l) △H2=+226.3 kJ·mol-1
(1)写出工业合成尿素的热化学方程式:________
(2)下列措施中有利于提高尿素的产率的是___________。
A.采用高温 B.采用高压 C.添加高效催化剂 D.定时分离尿素
(3)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第________步反应决定。
②反应进行到10 min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)=________。
(4)工业上合成氨常与尿素生产联合进行以提高经济效益,合成氨的热化学方程式如下:
N2(g) + 3H2(g)  2NH3(g) △H = —92.4 kJ/mol
2NH3(g) △H = —92.4 kJ/mol
请在答题卡的坐标图中,画出反应过程中体系的能量变化图(进行必要的标注)。
(5)有一工业投产前小实验:在一定温度和压强下,将6 molH2和2 molN2在2L密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的体积分数约为11.1%(即1/9),此时H2的转化率是多少?(写出计算过程,计算结果保留3位有效数字。)
-
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位。工业制硝酸的主要反应之一是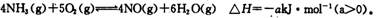
(1)如果将4mol NH3和5mol O2放入容器中,达到平衡时放出热量0.8akJ,则平衡时NH3的转化率为________。
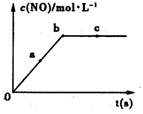
(2)在一定条件下,容积固定的密闭容器中进行上述反应,NO的浓度与时间关系如图所示,则NO的a、b、c三点的反应速率v(a正)、v(b逆)、v(c正)的大小关系是________。
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
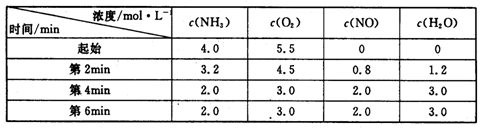
①第2min到第4mim,反应速率v(O2)=________;
②第2min时改变了条件,改变的条件可能是________(从所给选项中选择);
A.降低温度 B.增加了生成物 C.减小压强 D.使用了高效催化剂
③在与第4min相同的温度下,若起始向容器中加入NH3、O2、NO和H2O(g)的浓度都为2moI/L,则该反应________(填“正反应方向进行”、“逆反应方向进行”、“不移动”)。
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。尿素(H2NCONH2)是一种非常重要的高氮化肥,在温度70—95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2,尿素与NO、NO2三者等物质的量反应的化学方程式为。
(5)目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
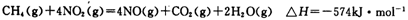
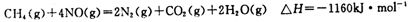
则1mol甲烷直接将NO2还原为N2的烩变为____________。
-
(14分)尿素[CO(NH2)2]是一种非常重要的高氮化肥,以天然气(含H2S)为原料合成尿素的主要步骤如下图所示(图中某些转化步骤未列出)。
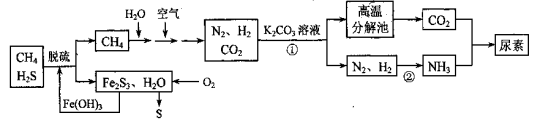
请回答下列问题:
(1)反应①的离子方程式是____________。
(2)天然气脱硫后产生的Fe2S3和H2O与02反应的化学方程式是_______。
(3)反应②N2+3H2 2NH3 △H<0,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不变”)。如该反应在恒容恒温条件下进行,下列说法能判断达到平衡的是 。
2NH3 △H<0,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不变”)。如该反应在恒容恒温条件下进行,下列说法能判断达到平衡的是 。
A.单位时间内生成nmol N2同时消耗3nmol H2
B.混合气体的密度不变
C.混合气体的平均摩尔质量不变
D.N2、H2、NH3浓度之比为1:3:2
(4)H2NCOONH4(氨基甲酸铵)是合成尿素的中间体,H2NCOONH4在水溶液中要发生水解反应,其水解反应的离子方程式为: 。
(5)如果整个生产过程釆用绿色化学工艺,则生产120t尿素理论上需要CH4__ _m3(标准状况)。
(6)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,工作时负极的电极反应式为_____。

-
尿素[CO(NH2)2]是一种非常重要的高氮化肥,以天然气(含H2S)为原料 合成尿素的主要步骤如下图所示(图中某些转化步骤未列出)。
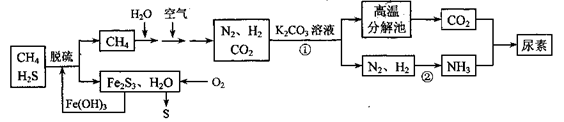
请回答下列问题:
(1)反应①的离子方程式是______________
(2)天然气脱硫后产生的Fe2S3和H2O与02反应的化学方程式是_______。
(3)反应②是放热反应,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不变”)。H2NCOONH4 (氨基甲酸铵)是合成尿素的中间体,其中碳原子的杂化轨道类型是_______杂化。
(4)如果整个生产过程釆用绿色化学工艺,则生产 120t尿素理论上需要 CH4___m3 (标准状况)。
(5)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,工作时负极的电极反应式为__________

H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1
H2NCOONH4(氨基甲酸铵)(l) △H1
H2O(l)+H2NCONH2(l) △H2.