-
(14分)尿素[CO(NH2)2]是一种非常重要的高氮化肥,以天然气(含H2S)为原料合成尿素的主要步骤如下图所示(图中某些转化步骤未列出)。
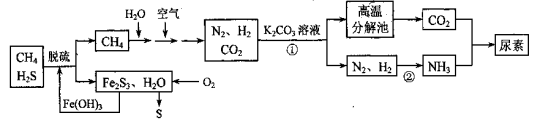
请回答下列问题:
(1)反应①的离子方程式是____________。
(2)天然气脱硫后产生的Fe2S3和H2O与02反应的化学方程式是_______。
(3)反应②N2+3H2 2NH3 △H<0,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不变”)。如该反应在恒容恒温条件下进行,下列说法能判断达到平衡的是 。
2NH3 △H<0,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不变”)。如该反应在恒容恒温条件下进行,下列说法能判断达到平衡的是 。
A.单位时间内生成nmol N2同时消耗3nmol H2
B.混合气体的密度不变
C.混合气体的平均摩尔质量不变
D.N2、H2、NH3浓度之比为1:3:2
(4)H2NCOONH4(氨基甲酸铵)是合成尿素的中间体,H2NCOONH4在水溶液中要发生水解反应,其水解反应的离子方程式为: 。
(5)如果整个生产过程釆用绿色化学工艺,则生产120t尿素理论上需要CH4__ _m3(标准状况)。
(6)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,工作时负极的电极反应式为_____。

-
尿素[CO(NH2)2]是一种非常重要的高氮化肥,以天然气(含H2S)为原料 合成尿素的主要步骤如下图所示(图中某些转化步骤未列出)。
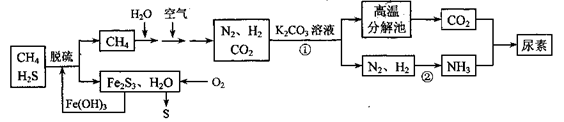
请回答下列问题:
(1)反应①的离子方程式是______________
(2)天然气脱硫后产生的Fe2S3和H2O与02反应的化学方程式是_______。
(3)反应②是放热反应,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不变”)。H2NCOONH4 (氨基甲酸铵)是合成尿素的中间体,其中碳原子的杂化轨道类型是_______杂化。
(4)如果整个生产过程釆用绿色化学工艺,则生产 120t尿素理论上需要 CH4___m3 (标准状况)。
(5)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,工作时负极的电极反应式为__________

-
工业上常利用CO2为初始反应物,合成一系列重要的化工原料。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)=NH2COONH4(s)ΔH1
反应Ⅱ:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1
总反应:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH3=-86.98 kJ·mol-1
请回答下列问题:
①反应Ⅰ的ΔH1=______________。
②在________(填“高温”或“低温”)情况下有利于反应Ⅱ的自发进行。
③一定温度下,在体积固定的密闭容器中按n(NH3)∶n(CO2)=2∶1 进行反应Ⅰ。下列能说明反应Ⅰ达到了平衡状态的是____________(填字母代号)。
A 混合气体的平均相对分子质量不再变化
B 容器内气体总压强不再变化
C NH3与CO2的转化率相等
D 容器内混合气体的密度不再变化
(2)将CO2和H2按质量比25∶3充入一定体积的密闭容器中,在不同温度下发生反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。测得CH3OH(g)的物质的量随时间的变化如下图所示。

①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为K(Ⅰ)______(填“>”“<”或“=”)K(Ⅱ)。
②欲提高CH3OH(g)的平衡产率,可采取的措施除改变温度外,还有__________(任写两种)。
③一定温度下,在容积均为2 L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后反应达到平衡。
| 容器 | 甲 | 乙 |
| 反应物起 始投入量 | 1 mol CO2、 3 mol H2 | a mol CO2 b mol H2 c mol CH3OH(g) c mol H2O(g) (a,b,c均不为0) |
若甲容器中反应达平衡后气体的压强为开始时的 ,则该温度下,反应的平衡常数为______;要使反应达平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_______________。
,则该温度下,反应的平衡常数为______;要使反应达平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_______________。
-
二氧化碳和氨是重要的化工产品,是纯碱工业、制造硝酸、铵盐和氮肥等的原料。
(1)CO2的电子式是 。
(2)以NH3与CO2为原料合成尿素[化学式为CO(NH2)2]的主要反应如下:
① 2NH3(g)+CO2(g) = NH2CO2NH4(s) △H=-l59.5 kJ·mol-1
② NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
③ H2O(1) = H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式 ;
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1
不同温度下NO产率如下图1所示,由此图可知温度对NO产率的影响规律为 ,请用化学反应速率和化学平衡理论解释其原因: 。
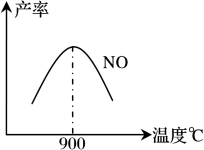
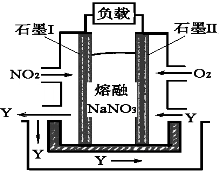
图1 图2
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如图2所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关石墨I电极反应可表示为_______________。
(5)已知常温下NH3·H2O的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11。 常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显__________(填“酸性”、“中性”或“碱性”);计算反应NH4++HCO3—+H2O NH3·H2O+H2CO3的平衡常数K= (结果保留2位有效数字)。
NH3·H2O+H2CO3的平衡常数K= (结果保留2位有效数字)。
-
二氧化碳和氨是重要的化工产品,是纯碱工业、制造硝酸、铵盐和氮肥等的原料。
(1)CO2的电子式是 。
(2)以NH3与CO2为原料合成尿素[化学式为CO(NH2)2]的主要反应如下:
① 2NH3(g)+CO2(g) = NH2CO2NH4(s) △H=-l59.5 kJ·mol-1
② NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
③ H2O(1) = H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式 ;
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1
不同温度下NO产率如下图1所示,由此图可知温度对NO产率的影响规律为 ,请用化学反应速率和化学平衡理论解释其原因: 。
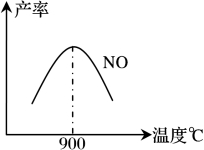
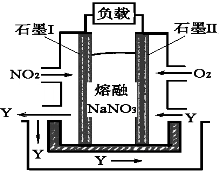
图1 图2
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如图2所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关石墨I电极反应可表示为_______________。
(5)已知常温下NH3·H2O的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11。 常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显__________(填“酸性”、“中性”或“碱性”);计算反应NH4++HCO3—+H2O NH3·H2O+H2CO3的平衡常数K= (结果保留2位有效数字)。
NH3·H2O+H2CO3的平衡常数K= (结果保留2位有效数字)。
-
(14分)天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。
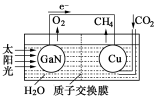
①写出铜电极表面的电极反应式 。
②为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“盐酸”或“硫酸”)。
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)  2CO(g)+2H2(g) 。
2CO(g)+2H2(g) 。
①该反应的平衡常数表达式为 。
②在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。
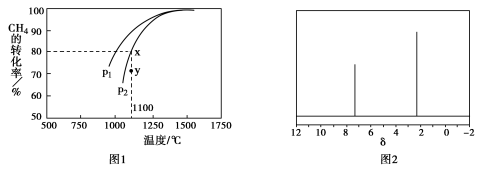
(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X。由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图2,则X的结构简式为 。
-
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):

请填写下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸气在t ℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量。该反应的热化学方程式是___________。
(2)上述流程中,工业上分离H2、CO2合理的方法是_____________________。
A.混合气先通入氢氧化钠溶液,再在溶液中加盐酸
B.混合气加压冷却,使CO2液化
C.混合气用氨水洗涤
D.混合气先通入到石灰浆,然后高温煅烧固体
(3)为了保证氨气顺利合成,在空气进入合成塔之前必须对空气进行________,目的是________________;
在合成氨的实际生产过程中,常采取将生成的氨从混合气体中分离出来,分离出氨的方法:________________。
(4)合理地利用资源不仅可以提高经济效益,而且也是对社会、对全人类负责的表现,请用线段和箭头画出图中的两处合理利用资源情况。
-
尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位.
(1)工业上合成尿素的反应如下:2NH3(l)+CO2(g)⇌H2O(l)+H2NCONH2(l)△H=-103.7kJ•mol-1
下列措施中有利于提高尿素的生成速率的是______
A.采用高温 B.采用高压
C.寻找更高效的催化剂 D.减小体系内CO2浓度
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)⇌H2NCOONH4(氨基甲酸铵)(l)△H1
第二步:H2NCOONH4(l)⇌H2O(l)+H2NCONH2(l)△H2.
某实验小组模拟工业上合成尿素的条件,在一体积为0.5L密闭容器中投入4mol氨和l mol二氧化碳,实验测得反应中各组分随时间的变化如下图I所示:
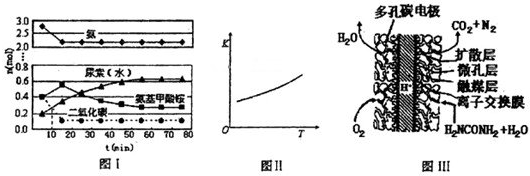
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第______步反应决定,总反应进行到______min时到达平衡.
②第二步反应的平衡常数K随温度的变化如上图II所示,则△H2______0(填“>”“<”或“=”)
(3)在温度70-95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2
①尿素与NO、NO2三者等物质的量反应,化学方程式为______.
②已知:N2(g)+O2(g)═2NO(g).△H=180.6kJ•mol-1
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=______kJ•mol-1
(4)尿素燃料电池结构如上图III所示.其工作时负极电极反应式可表示为______.
-
尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1
下列措施中有利于提高尿素的生成速率的是________
A.采用高温
B.采用高压
C.寻找更高效的催化剂
D.减小体系内CO2浓度
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)  H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4(l)  H2O(l)+H2NCONH2(l) △H2.
H2O(l)+H2NCONH2(l) △H2.
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和l mol二氧化碳,实验测得反应中各组分随时间的变化如下图I所示:
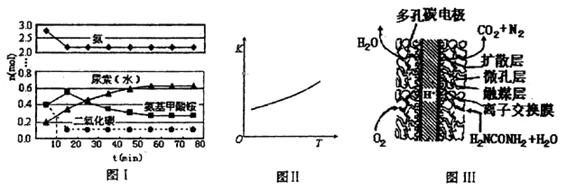
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第________步反应决定,总反应进行到________min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上图II所示,则△H2 ________0(填“>” “<” 或 “=”)
(3)在温度70-95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2
①尿素与NO、NO2三者等物质的量反应,化学方程式为
________
②已知:N2(g)+O2(g)=2NO(g).△H=180.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol-1
则4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g) △H=________kJ·mol-1
(4)尿素燃料电池结构如上图III所示。其工作时负极电极反应式
可表示为________ 。
-
(15分)
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某
些转化步骤及生成物未列出):

请填写下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸气在t ℃,p k Pa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量。该反应的热化学方程式是:______。
(2)上述流程中,工业上分离H2 、CO2合理的方法是___________。
A.混合气先通入氢氧化钠溶液,再在溶液中加盐酸
B.混合气加压冷却,使CO2液化
C.混合气用氨水洗涤
D.混合气先通入到石灰浆,然后高温煅烧固体,
(3)为了保证氨气顺利合成,在空气进入合成塔之前必须对空气进行___________,目的是________________________________________;在合成氨的实际生产过程中,常采取将生成的氨从混合气体中分离出来,分离出氨的方法:________。
(4)合理地利用资源不仅可以提高经济效益,而且也是对社会、对全人类负责的表现,请用线段和箭头画出图中的两处合理利用资源情况。

2NH3 △H<0,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不变”)。如该反应在恒容恒温条件下进行,下列说法能判断达到平衡的是 。













