-
高科技材料与生活、生产、科技密切相关。下列关于2017年我国重点发展的科技材料说法错误的是
A. 生物塑料可减少白色污染
B. 用于“天宫二号”的纳米陶瓷铝合金硬度大
C. 高性能分离膜可用于海水淡化
D. 用于3D打印材料的光敏树酯是纯净物
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是
A. 企鹅分子(如下图)中所有的碳原子可能共处同一平面

B. 乙酸与2-羟基乙醛互为同分异构体
C. 甲醇与甘油互为同系物
D. 工业制备聚丙烯方程式为: nCH2=CH-CH3
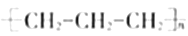
难度: 中等查看答案及解析
-
NH4N3(叠氮化铵)易发生爆炸反应: NH4N3
2N2↑+2H2↑,NA为阿伏加德罗常数的值,下列说法正确的是
A. 1.8gNH4+中含有的质子数为1NA
B. N2既是氧化产物,又是还原产物
C. 爆炸反应中,当转移4NA个电子时,产生89.6L (标准状态)混合气体
D. 6g的NH4N3晶体中含有的阴离子个数为0.3NA
难度: 中等查看答案及解析
-
下列实验操作不能达到预期实验目的的是
选项
实验操作
实验目的
A
将SO2和CO2的混合气体依次缓缓通过足量的溴水、澄清石灰水
检验混合气体中的SO2和CO2
B
向硫酸亚铁溶液中逐滴加入氢氧化钠溶液
制备纯净的氢氧化亚铁
C
将适量Na2O2裹入棉花中,再滴入少量的水
证明Na2O2与水反应是放热反应
D
向硫化钠溶液中滴加氯水
证明非金属性氯大于硫
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,且只有一种元素为金属元素。其中X、Z同主族。X、Y、Z的原子最外层电子数之和为15,则下列说法错误的是
A. Y、Z、W一定同周期 B. 简单氢化物稳定性: X>Z
C. X.Y 组成的化合物具有两性 D. 离子半径大小: Z>W>Y>X
难度: 困难查看答案及解析
-
近期使用的一种可控电池——锂水电池工作原理如下图。下列说法错误的是
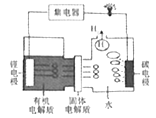
A. 锂电极是电池的负极
B. 正极发生的反应为: 2H2O+2e-=2OH-+ H2↑
C. 水中H+经固体电解质向锂电极移动
D. 理论上每消耗14g锂,转移的电子数为2NA
难度: 困难查看答案及解析
-
25℃时,将0.1mo/L的NaOH溶液滴入盛有50mL pH= 2的H A溶液的绝热容器中,加入NaOH溶液的体积V与溶液温度T的关系如下图。下列说法正确的是
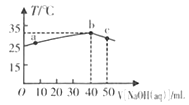
A. a点溶液中,c(A-)+ c(HA)= 0.08mol/L.
B. b点溶液中,c(A-)<c(Na+))
C. b → c的过程中,发生了吸热反应
D. 溶液中HA的电离平衡常数a点等于b点
难度: 中等查看答案及解析
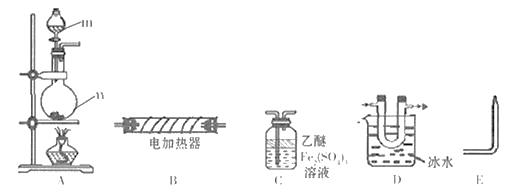
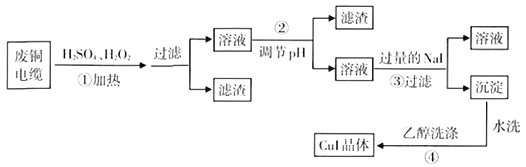
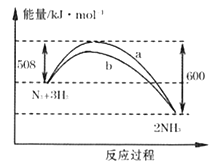
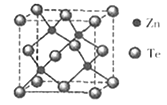
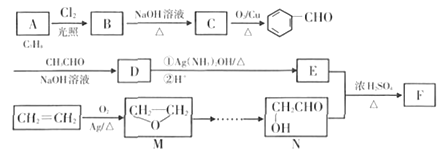
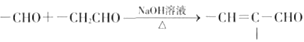 ,回答下列问题:
,回答下列问题: