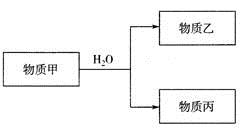
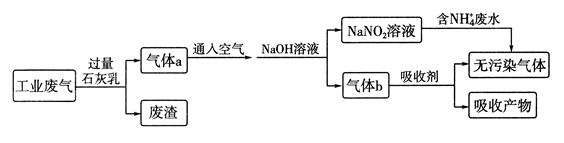
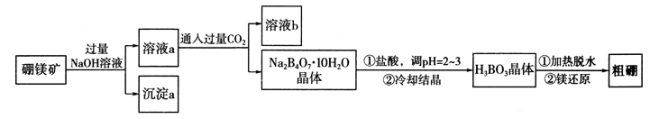
-
化学与社会、环境密切相关,下列有关说法错误的是
A.水玻璃可用于制备硅胶和木材防火剂
B.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
C.煤的气化是物理变化,是
高效、清洁地利用煤的重要途径
D.侯氏制碱法的工艺过程中应用了物质溶解度的差异
难度: 简单查看答案及解析
-
下列与化学概念有关的说法正确的是
A.Na2O、CaO、Al2O3均为碱性氧化物
B.液溴不导电,所以液溴是非电解质
C.12C与13C的核外电子排布方式相同,化学性质相同
D.只含共价键的物质一定是共价化合物
难度: 中等查看答案及解析
-
下列应用涉及氧化还原反应的是
A.纯碱用于制造玻璃
B.医药上用小苏打治疗胃酸过多
C.打磨磁石制指南针
D.工业上利用合成氨实现人工固氮
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.
1L pH=l的硫酸溶液中含有的H+数目为0.2NA
B.1 mol羟基与l mol氢氧根离子所含质子数均为9NA
C. 14 g由N2与CO组成的混合气体中含有的原子数
目为2NA
D.标准状况下,2.24 L Cl2溶于水,转移的电子数目为0.1NA
难度: 困难查看答案及解析
-
下列物质的性质与实际应用对应关系错误的是
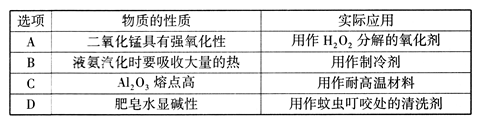
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z在元素周期表中的相对位置如下图所示。下列说法一定正确的是
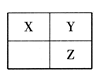
A. 气态氢化物的沸点:X<Y<Z
B. 最高正化合价:Y>X
C. X、Y、Z的最高价氧化物对应水化物中,Z的酸性最强
D. 若X、Y、Z的原子序数之和等于25,则它们都是非金属元素
难度: 中等查看答案及解析
-
下列各组离子在指
定溶液中可能大量共存的是
A.弱碱性溶液中:Na+、K+、Cl-、HCO3-;
B.“84”消毒液中:SiO32-、CO32-、Na+、S2-
C.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
D.0.1mol·L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42-
难度: 中等查看答案及解析
-
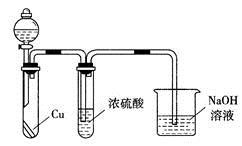
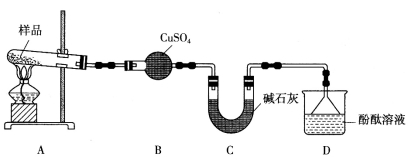
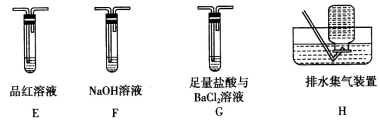
下列实验操作或装置(略去部分夹持仪器)正确的是
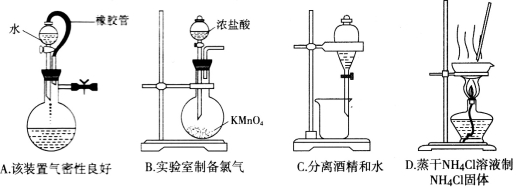
难度: 中等查看答案及解析
-
下列有关元素及其化合物的说法正确的是
A.水蒸气通过灼热的铁粉生成氢氧化铁和氢气
B.Mg比Al活泼,更易与NaOH溶液反应生成H2
C.Na在空气中长期放置最终变为Na2CO3粉末
D.向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀
难度: 中等查看答案及解析
-
下列实验的反应原理用离子方程式表示正确的是
A.明矾净水:Al3++3H2O=Al(OH)3↓+3H+
B.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
C.用CuCl2溶液做导电实验,灯泡发光:CuCl2
Cu2++2C1-
D.用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
难度: 中等查看答案及解析
-
下列有关实验操作、现象和结论均正确的是

难度: 中等查看答案及解析
-
二氧化氯(ClO2)能净化有毒废水中的氰化钠(NaCN),生成NaCl、C
O2和N2,下列说法正确的是
A.被氧化的元素是氯元素
B.氧化产物与还原产物的物质的量之比为l:1
C.消耗l mol还原剂,转移5 mol电子
D.净化1 L含CN-1.04 mg·L-1的废水,理论上需用2×l0-5mol C1O2
难度: 困难查看答案及解析
-
下列物质在一定条件下可以转化的是
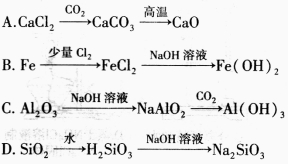
难度: 中等查看答案及解析
-
某化合物通过化合反应生成,向其水溶液中加入足量Na2O2,最终有白色沉淀产生。下列化合物中符合上述条件的是
A.Ca(HCO3)2 B.Na2S C.FeI2 D.AlCl3
难度: 中等查看答案及解析
-
单质Z是一种常见的半导体材料,可由X通过如下图所示的路线制备。
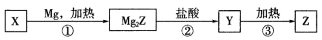
其中X为Z的氧化物;Y为氢化物,分子结构与甲烷相似。下列说法错误的是
A.X可以和氢氟酸反应
B.甲烷的稳定性比Y强
C.Z是将太阳能转换为电能的常用材料
D.上述①②③变化过程中,依次发生置换反应、复分解反应和分解反应
难度: 中等查看答案及解析
-
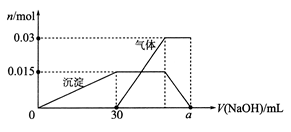
部分被氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共8.0 g,经如下处理:
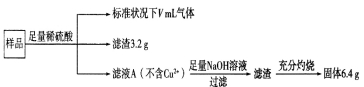
下列说法正确的是
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.该样品中Cu、O元素的质量比为10:l
C.V=448
D.溶解样品时消耗H2SO4的物质的量为0.04 mo1
难度: 极难查看答案及解析