-
对于Fe+CuSO4===Cu+FeSO4这一反应或反应中涉及到的物质理解不正确的是
A. 该反应为置换反应
B. 该反应体现出Fe具有还原性
C. 该反应体现CuSO4作为盐的通性
D. CuSO4溶液中有Cu2+、SO42-、CuSO4、H+ 、OH-、H2O等
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A. 葡萄糖的结构简式: C6H12O6
B. BCl3的电子式:

C. 硫离子的结构示意图:
D. 质量数为44,中子数为24 的钙原子:
难度: 中等查看答案及解析
-
古诗词或谚语中包含了丰富的化学知识,下列解释正确的是( )
选项
古诗或谚语
含有的化学反应类型
A
熬胆矾铁釜,久之亦化为铜
The iron cauldron, which has long been transformed into copper
复分解反应
B
千锤万凿出深山,烈火焚烧若等闲
Thousands of hammer chiseled out of the deep mountain, and the fire was burned
分解反应
C
春蚕到死丝方尽,蜡炬成灰泪始干
A spring silkworm may not stop spinning silk until death, a candle's tears dry only when it's burn...
化合反应
D
爆竹声中除旧岁,春风送暖人屠苏
The sound of the firecracker in the sound of the old year, the spring breeze to warm the people
置换、分解反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
分类是化学学习的一种重要方法,下列有关分类正确的是( )
①混合物:氯水、氨水、水玻璃、水银、福尔马林、淀粉
②含有氧元素的化合物叫氧化物
③CO2、NO、P2O5均为酸性氧化物,Na2O、Na2O2均为碱性氧化物
④同位素:1H+、2H2、3H
⑤同素异形体:C60、C80、金刚石、石墨
⑥浓盐酸、浓硫酸、浓硝酸均具有氧化性,都属于氧化性酸
⑦化合物:烧碱、冰醋酸、HD、聚氯乙烯
⑧强电解质溶液的导电能力一定强
⑨在熔化状态下能导电的化合物为离子化合物
⑩有单质参加的反应或有单质产生的反应是氧化还原反应
A. 全部正确 B. ①②⑤⑦⑨ C. ⑤⑨ D. ②⑤⑥⑦⑨⑩
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确有( )个
①常温常压下,28gC2H4和C4H8的混合物中一定含有6NA个原子
②0℃,101kPa,22.4LCl2通入足量的NaOH溶液充分反应,有2NA个电子转移
③常温下,pH=12的氢氧化钠溶液中OH-数目为0.01NA
④1L1.0mol/LFeCl3溶液全部水解制备氢氧化铁胶体,所得氢氧化铁胶体数目为NA
⑤同温同压下,O2和CO组成的混合气体的密度是氢气的15倍,则O2和CO的体积比1:1
⑥常温下,1.7gNH3和3.65gHCl混合后,气体分子数为0.2NA
⑦lmolSO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
⑧100克质量分数为46%的乙醇溶液中,含有的氧原子数目为4NA
⑨标准状况下,22.4LHF气体中含有NA个气体分子
A. 4 B. 1 C. 2 D. 3
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
①pH = 0的溶液:Na+、C2O42—、MnO4—、SO42—
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③由水电离出的H+浓度c(H+)水=10-12mol·L-1的溶液中:Cl-、CO32-、NO3-、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
⑤使甲基橙变黄的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
⑥中性溶液中:Fe3+、Al3+、NO3-、Cl-、S2-
A. ②④ B. ①③⑤ C. ②⑤⑥ D. ①④⑤
难度: 困难查看答案及解析
-
有一混合溶液,只可能含有以下离子中的若干种:K+、
、Cl-、Mg2+、Ba2+、
、
,现取三份100 mL该溶液进行如下实验:
(1)向第一份溶液中加入AgNO3溶液时有沉淀产生;
(2)向第二份溶液中加入足量NaOH溶液并加热后,收集到气体0.06 mol;
(3)向第三份溶液中加入足量BaCl2溶液后,所得沉淀经洗涤、干燥、称量为8.24 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。
根据上述实验,以下推测正确的是( )
A. K+可能存在 B. 100 mL溶液中含0.01 mol
C. Cl−可能存在 D. Ba2+一定不存在,Mg2+可能存在
难度: 困难查看答案及解析
-
AlN广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C
2AlN+3CO合成。下列叙述正确的是( )
A. AlN为氧化产物
B. AlN的摩尔质量为41g
C. 上述反应中,每生成1molAlN需转移3mol电子
D. 上述反应中,N2是还原剂,Al2O3是氧化剂
难度: 困难查看答案及解析
-
下列实验预期的现象及结论都正确的是( )
选项
实验
预期现象
预期结论
A
将SO2气体通入Ba(NO3)2溶液中
有白色沉淀生成
H2SO3与Ba(NO3)2发生复分解反应生成BaSO3
B
向盛有KI溶液的试管中,滴加少量新制氯水和CCl4,振荡、静置
下层溶液显紫色
Cl2氧化性比I2强
C
铜放入稀硫酸中,无明显现象,再加入硝酸钠固体
溶液变蓝,有明显的气泡放出,铜溶解
硝酸钠可以加快铜与稀硫酸的反应速率,起到了催化剂的作用
D
向FeCl3饱和溶液中逐滴滴入足量浓氨水,并加热至沸腾
生成红褐色透明液体
得到Fe(OH)3胶体
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中,不正确的是
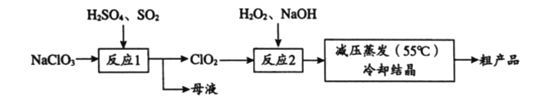
A. 反应1中,每生成1 mol ClO2有0.5 mol SO2被氧化
B. 从母液中可以提取Na2SO4
C. 反应2中,H2O2做氧化剂
D. 采用减压蒸发可能是为了防止NaClO2受热分解
难度: 困难查看答案及解析
-
NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠应用于冶金、燃料,皮革,电镀等工业。硫化钠的一种制备方法是Na2SO4+2C
Na2S+2CO2↑。下列有关说法正确的是
A. 1mol/LNa2SO4溶液中含氧原于的数目一定大于4NA
B. 1L0.1mol/LNa2S溶液中含阴离子的数目小于0.1NA
C. 生成1mol氧化产物时转移电子数为4NA
D. 通常状况下,11.2LCO2中含质子的数目为11NA
难度: 中等查看答案及解析
-
已知常温下,几种物质的电离平衡常数,下列反应的离子方程式正确的有几个
弱酸
HCOOH
HCN
H2CO3
HClO
苯酚
K25℃
K=1.77×10-4
K=4.9×10-10
K1=4.3×10-7
K2=5.6×10-11
K=2.98×10-8
K=1.1×10-10
①向苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
②次氯酸钙溶液中通入少量二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
③次氯酸钠溶液中通入少量二氧化碳:2C1O-+H2O+CO2=2HClO+CO32-
④次氯酸钠溶液中通入少量二氧化硫:3ClO-+SO2+H2O=SO42-+2HClO+Cl-
⑤纯碱溶液中滴加少量甲酸:2HCOOH+CO32-=2HCOO-+H2O+CO2↑
⑥碳酸钠溶液中通入过量氯气:Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
⑦NaCN溶液中通入少量的CO2:CN-+CO2+H2O=HCO3-+HCN
A. 2个 B. 3个 C. 4个 D. 5个
难度: 困难查看答案及解析
-
标准状况下VL氨气溶解在1L水中(水的密度近似为1g·mL -1 ),所得溶液的密度为ρg·mL -1,质量分数为ω,物质的量浓度为cmol·L -1,则下列关系中不正确的是
A. ρ=(17V+22400)/(22.4+22.4V)
B. ω=17c/1000ρ
C. ω=17V/(17V+22400)
D. c=1000Vρ/(17V+22400)
难度: 中等查看答案及解析
-
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。下列说法正确的是
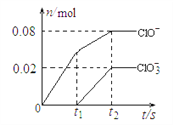
A. 苛性钾溶液中KOH的质量是5.6 g
B. 反应中转移电子的物质的量是0.18mol
C. 在酸性条件下 ClO- 和ClO3-可生成Cl2
D. 一定有3.136 L氯气参与反应
难度: 困难查看答案及解析