-
下列环保建议中,你认为不能采纳的是
A.开发、使用新能源
B.废旧电池应集中回收,并填埋处理
C.用天然气代替汽油和柴油作发动机燃料
D.禁止将未经处理的工业废水和生活污水任意排放
难度: 简单查看答案及解析
-
能正确表示下列反应的离子方程式是
A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+
C.NaHCO3溶液与稀H2SO4反应:CO32一+2H+=H2O+CO2↑
D.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4+AlO2一+2H2O
难度: 中等查看答案及解析
-
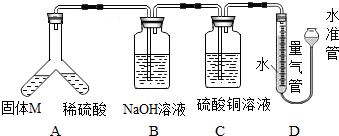
下列实验装置能达到相应实验目的是

A.用图1装置制取Fe(OH)2沉淀
B.用图2装置吸收NH3,并防止倒吸
C.用图3装置蒸干AlCl3饱和溶液制备AlCl3晶体
D.用图4装置比较Na2C03与NaHC03的稳定性
难度: 中等查看答案及解析
-
某有机化合物的结构简式为
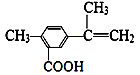 ,有关该化合物的叙述不正确的是
,有关该化合物的叙述不正确的是A.该有机物的分子式为C11H12O2
B.lmol该物质最多能与4molH2发生加成反应
C.该有机物能与热的新制氢氧化铜悬浊液反应,生成砖红色沉淀
D.该有机物一定条件下,可以发生取代、氧化、酯化反应
难度: 中等查看答案及解析
-
高温下,某反应达到平衡,平衡常数K=
,恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2O
CO2+H2
难度: 中等查看答案及解析
-
物质的量浓度相等的三种溶液:①H2CO3②NaOH③Na2CO3溶液,下列说法不正确的是
A.水电离出的c(OH):③>①>②
B.溶液的pH:②>③>①
C.①和②等体积混合后的溶液:c(Na+)=c(H2CO3)+c(HCO3)+c(CO32-)
D.①和③等体积混合后的溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
难度: 简单查看答案及解析
-
利用下列装置,可完成很多电化学实验。下列有关叙述,正确的是

A.若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阴极的阳极保护法
B.若X为铜棒,开关K置于A处,装置中发生的总反应为:2NaCl+2H2O
2NaOH+Cl2+H2
C.若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到碳棒附近先变红
D.若X为碳棒,开关K置于B处,在铁棒附近滴入硫氰化钾溶液可看到溶液变血红色
难度: 中等查看答案及解析