-
有X、Z、W三种含14个电子的粒子,其结构特点如下:
| 粒子代码 | X | Z | W |
| 原子核数目 | 单核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电性 | 电中性 | 两个负电荷 | 电中性 |
(1)X的氧化物晶体中含有化学键类型是_____________。
(2)Z与钙离子组成的化合物的电子式为_____________。
(3)组成W的元素的简单氢化物极易溶于水的主要原因是 ,该氢化物与空气可以构成一种燃料电池,产物为无毒物质,电解质溶液是KOH溶液,其负极的电极反应式为____ 。在常温下,用该电池电解1.5 L 1mol/LNaCl溶液,当消耗标准状况下1.12LW的简单氯化物时,NaCl溶液的pH=
(假设电解过程中溶液的体积不变)。
(4)M原子核外比X原子多2个电子。可逆反应2MO2(气)+O2(气) 2MO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B容器可保持恒容(如图所示),若在A、B中分别充入1molO2和2mol MO2,使气体体积V(A)=V(B),在相同温度下反应。则:达平衡所需时间:t(A)___________t (B)(填“>”、“<”、“=”,或“无法确定”,下同)。平衡时MO2的转化率:a(A)_____________a(B)。
2MO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B容器可保持恒容(如图所示),若在A、B中分别充入1molO2和2mol MO2,使气体体积V(A)=V(B),在相同温度下反应。则:达平衡所需时间:t(A)___________t (B)(填“>”、“<”、“=”,或“无法确定”,下同)。平衡时MO2的转化率:a(A)_____________a(B)。
(5)欲比较X和M两元素的非金属性相对强弱,可采取的措施有 (填序号)。

a.比较这两种元素的气态氢化物的沸点
b.比较这两种元素的单质在常温下的状态
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素的单质与氢气化合的难易
-
有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
 原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含
原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含 的氧化物晶体中含有共价键数目为 ______
的氧化物晶体中含有共价键数目为 ______
 与钙离子组成的化合物的电子式为 ______
与钙离子组成的化合物的电子式为 ______
 完全燃烧放出的热量是
完全燃烧放出的热量是 ,写出Y燃烧的热化学方程式 ______
,写出Y燃烧的热化学方程式 ______
 组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系
组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系 反应条件和其他物质已略
反应条件和其他物质已略

 写出丁在高温下与水反应的化学方程式 ______
写出丁在高温下与水反应的化学方程式 ______
 组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。
组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。
-
有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
 原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含
原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含 的氧化物晶体中含有共价键数目为 ______
的氧化物晶体中含有共价键数目为 ______
 与钙离子组成的化合物的电子式为 ______
与钙离子组成的化合物的电子式为 ______
 完全燃烧放出的热量是
完全燃烧放出的热量是 ,写出Y燃烧的热化学方程式 ______
,写出Y燃烧的热化学方程式 ______
 组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系
组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系 反应条件和其他物质已略
反应条件和其他物质已略

 写出丁在高温下与水反应的化学方程式 ______
写出丁在高温下与水反应的化学方程式 ______
 组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。
组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。
-
有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
(1)A原子核外比X原子多3个电子,A的原子结构示意图是________。含lmolX的氧化物晶体中含有共价键数目为________。
(2)Z与钙离子组成的化合物的电子式为________。
(3)14gY完全燃烧放出的热量是141.5kJ,写出Y燃烧的热化学方程式________。
(4)组成W的元素最高价氧化物对应的水化物甲有下图所示转化关系(丁为金属单质,反应条件和其他物质已略)

①写出丁元素在周期表中的位置________。
②写出丁在高温下与水反应的化学方程式________。
③组成W的元素的简单氢化物极易溶于水的主要原因是________,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为________。
-
已知X、Y、Z为三种由短周期元素构成的10个电子的粒子,其结构特点如下:
| 粒子代码 | X | Y | Z |
| 原子核数 | 单核 | 两核 | 四核 |
| 粒子的电荷数 | 一个单位正电荷 | 一个单位负电荷 | 0 |
物质A由X、Y构成, B、C、D、K都是单质,各有关物质之间的相互反应转化关系如下图所示,反应①~⑤都是用于工业生产的反应,反应⑥中个别产物在图中略去。请填写下列空白:
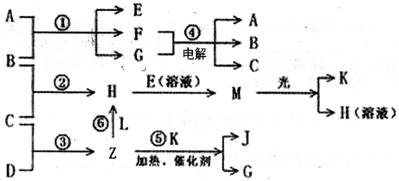
(1)Y的化学式是_______,Z分子的空间构型为_______,A的电子式为_______。
(2)写出下列反应的离子反应方程式:
H+E(溶液)→M________________________________________________________
F+G→A+B+C_____________________________________________
(3)L是由3种元素构成的分子,能与Z以1:2的物质的量之比反应生成尿素CO(NH2)2和物质H,写出L的结构式:____________。
(4)常温下,实验室模拟工业反应④的过程如右图所示,标况下,当电极上产生112mL(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=______。(假设气体完全逸出,溶液体积不变)

-
已知a、e、I为三种由短周期元素构成的10个电子的粒子,其结构特点如下:
| 粒子代码 | a | e | I |
| 原子核数 | 单核 | 两核 | 四核 |
| 粒子的电荷数 | 一个单位正电荷 | 一个单位负电荷 | |
物质A由a、e 构成,B、C、D、K都是单质,各有关物质之间的相互反应转化关系如下图所示,反应①-⑤都是用于工业生产的反应,⑥、⑦反应中个别产物在图中略去.请填写下列空白:
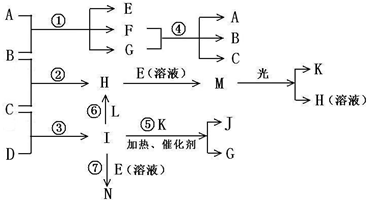
(1)写出下列物质的化学式:B______,J______.
(2)写出下列反应的离子反应方程式:H+E(溶液)→M______,F+G→A+B+C______ Cl2+H2+2OH-
-
已知a、e、I为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | e | I |
| 原子核数 | 单核 | 两核 | 四核 |
| 粒子的电荷数 | 一个单位正电荷 | 一个单位负电荷 | 0 |
物质A由a、e 构成, B、C、D、K都是单质,各有关物质之间的相互反应转化关系如下图所示,反应①—⑤ 都是用于工业生产的反应,⑥、⑦反应中个别产物在图中略去。
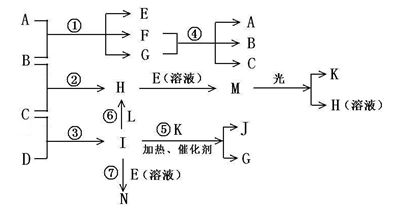
请填写下列空白:
(1)写出下列物质的化学式:B__________,J__________。
(2)写出下列反应的离子反应方程式:
H + E(溶液)→M____________________________________________________,
F + G →A + B + C________________________________________;
(3)E(溶液)能与I以1∶2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,写出N的结构式__________;
(4)L是由3种元素构成的分子,能与I以1∶2的物质的量之比反应生成尿素CO(NH2) 2 和物质H,写出L的电子式__________;
(5)反应③用于工业生产它应在_______________进行(填设备名称);反应④用于工业生产时为了防止B和C混合反应产生危险,所使用的一种特殊材料的名称为__________,在该工业生产中它具有的特殊的性质是________________________。
(6)常温下,实验室模拟工业反应④的过程如下图所示,标况下,当电极上产生112mL(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=__________。(假设气体完全逸出,溶液体积不变)

-
已知a、e、I为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | e | I |
| 原子核数 | 单核 | 两核 | 四核 |
| 粒子的电荷数 | 一个单位正电荷 | 一个单位负电荷 | 0 |
物质A由a、e 构成, B、C、D、K都是单质,各有关物质之间的相互反应转化关系如下图所示,反应①—⑤ 都是用于工业生产的反应,⑥、⑦反应中个别产物在图中略去。请填写下列空白:
(1)写出下列物质的化学式:B__________,J__________。
(2)写出下列反应的离子反应方程式:
H + E(溶液)→M_____________________________,
F + G →A + B + C________________________________________;
(3)E(溶液)能与I以1∶2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,写出N的结构式__________;
(4)L是由3种元素构成的分子,能与I以1∶2的物质的量之比反应生成尿素CO(NH2) 2 和物质H,写出L的电子式__________;
(5)反应③用于工业生产它应在_______________进行(填设备名称);反应④用于工业生产时为了防止B和C混合反应产生危险,所使用的一种特殊材料的名称为__________,在该工业生产中它具有的特殊的性质是___________________。
(6)常温下,实验室模拟工业反应④的过程如下图所示,标况下,当电极上产生112mL(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=__________。(假设气体完全逸出,溶液体积不变)

-
a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
| 微粒代码 | a | b | c |
| 原子核数 | 单核 | 单核 | 双核 |
带电荷数
(单位电荷) | | 1+ | 1- |
| d | e | f | g |
| 多核 | 单核 | 多核 | 多核 |
| 2+ | 1+ | |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子.
试写出:
(1)a微粒的核外电子排布式______
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为______>______ (用化学式表示)
(3)g微粒所构成的晶体类型属______.
-
a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
| 微粒代码 | a | b | c |
| 原子核数 | 单核 | 单核 | 双核 |
| 带电荷数 (单位电荷) | 0 | 1+ | 1- |
| d | e | f | g |
| 多核 | 单核 | 多核 | 多核 |
| 0 | 2+ | 1+ | 0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。
试写出:
(1)a微粒的核外电子排布式 ________
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为
________>________ (用化学式表示)
(3)g微粒所构成的晶体类型属 ________
2MO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B容器可保持恒容(如图所示),若在A、B中分别充入1molO2和2mol MO2,使气体体积V(A)=V(B),在相同温度下反应。则:达平衡所需时间:t(A)___________t (B)(填“>”、“<”、“=”,或“无法确定”,下同)。平衡时MO2的转化率:a(A)_____________a(B)。









