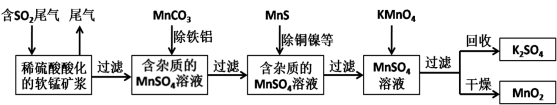
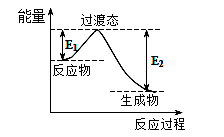
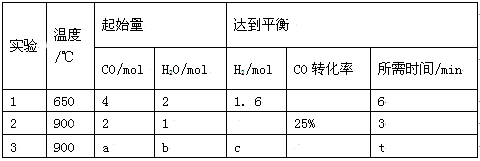
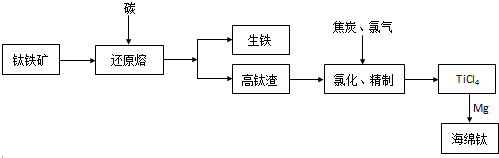
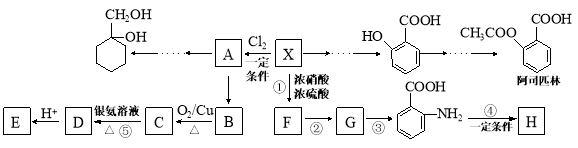
-
下列关于“化学与健康”的说法正确的是
A.苹果放在空气中久置变黄和纸张久置变黄原理相似
B.H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的还原性
C.采用的新型氢动力计程车可以降低PM2.5的排放,减小大气污染
D.生石灰、铁粉、硅胶是食品包装中常用的干燥剂
难度: 简单查看答案及解析
-
分子式为C5H10O3的有机物与NaHCO3溶液反应时,生成C5H9O3Na;而与金属钠反应时生成C5H8O3N
a2。则该有机物的同分异构体的种类(不考虑立体异构)有
A.10种 B.11种 C.12种 D.13种
难度: 困难查看答案及解析
-
下列装置所示的实验不能达到目的的是
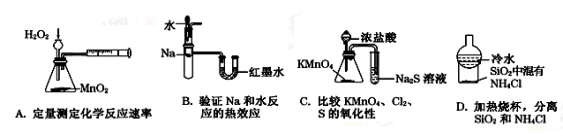
难度: 中等查看答案及解析
-
常温下,下列溶液中的微粒浓度关系正确的是
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+) >c(OH-)=c(H+)
D.0.2mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合:c(H+) + C(CH3COOH) < C(CH3COO-) + c(OH-)
难度: 困难查看答案及解析
-
下列有关离子反应的方程式书写正确的是
A.向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
B.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2+ + 2OH- +
+ HCO3- = BaCO3↓ + NH3·H2O + H2O
C.氢氧化钙溶液与碳酸氢镁溶液反应:HCO3- + Ca2+ + OH- = CaCO3↓ + H2O
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO- + 2Fe(OH)3 = 2Fe
+ 3Cl- + H2O + 4H+
难度: 困难查看答案及解析
-
下列叙述正确的选项是
A.对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都随温度的升高而增大。
B.结构式为
的物质互为同分异构体
C.根据反应:NaA+CO2(少量)+ H2O==HA+NaHCO3 ; 2NaB+CO2+H2O== 2HB+Na2CO3,可以得出酸的强弱的顺序为:H2CO3 > HA> HCO3 — > HB
D.过硼酸钠晶体(NaBO3·4H2O)是一种优良的漂白剂,在70℃以上加热该晶体30.80克,反应后称量固体质量为27.20克,则该固体物质的化学式为NaBO3.H2O。
难度: 困难查看答案及解析
-
现有X、Y、Z、M四种短周期元素,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍。下列说法不正确的是
A. 简单阳离子的氧化性:Y>X
B. 气态氢化物的稳定性:Z<M
C. 简单离子半径由大到小的顺序是:Z>M>Y
D. 等浓度的X2Z与Y2Z的溶液中,水的电离程度:X2Z<Y2Z
难度: 中等查看答案及解析