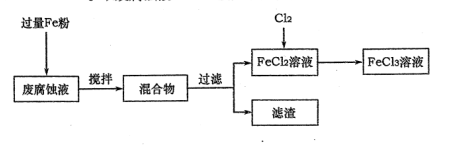
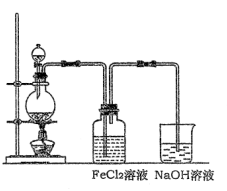
-
以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。下列做法违背发展低碳经济要求的是
A.发展氢能和太阳能
B.举行“地球一小时"熄灯活动
C.限制塑料制品的使用
D.种植农作物时大量使用化肥和农药
难度: 简单查看答案及解析
-
日常生活中很多问题涉及到化学知识。下列叙述错误的是
A.用食醋清洗热水瓶中的水垢
B.用米汤检验碘盐中含有碘酸钾
C.用纯碱溶液洗涤餐具上的油污
D.用丁达尔效应区别鸡蛋自溶液和食盐水
难度: 简单查看答案及解析
-
下列说法正确的是
A.由同种元素组成的物质一定是纯净物
B.用pH试纸测得25OC时某溶液的pH为4.0
C. BaS04、Ca(OH)2、HN03均为强电解质
D.室温下向饱和AgCl溶液中加入盐酸,Ksp(AgCl)变大
难度: 简单查看答案及解析
-
下列说法正确的是
A.阳离子只有氧化性,阴离子只有还原性
B. 失电子难的原子获得电子的能力一定强
C. 得到电子越多的氧化剂,其氧化性就越强
D.要实现Fe2+ → Fe3+的转化,必须加入氧化剂
难度: 简单查看答案及解析
-
下列反应中,改变反应物的用量或浓度,不会改变反应产物种类的是
A.碳粉在氧气中燃烧 B. C02通入氢氧化钠溶液
C. 铁在氯气中燃烧 D.铜和硝酸反应
难度: 简单查看答案及解析
-
下列说法正确的是
A.石油的分馏和煤的于馏都是物理变化
B. 可用饱和碳酸钠溶液除去乙酸乙酯中混有的乙酸
C. 淀粉、纤维素的化学式都可表示为(C6Hl005)n,二者互为同分异构体
D.淀粉、油脂和蛋白质都是高分子化合物
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,189D2O中所含的质子数为10NA
B. 28gN2和C0的混合气体中含有的分子数为NA
C.标准状况下,11.2LO2参加反应转移的电子数一定为2 NA
D. 5.6g铁与足量稀硫酸反应失去电子数为0.3 NA
难度: 简单查看答案及解析
-
下列实验操作正确的是

难度: 简单查看答案及解析
-
下列说法正确的是
A. S02和Cl2都能使品红溶液褪色,且加热后均恢复原色
B.Si02是酸性氧化物,能与NaOH溶液反应
C.高温时,CuO比Cu2O稳定
D.将铜片放入浓硫酸中,无明显现象,说明铜在冷的浓硫酸中发生钝化
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.氯气溶于水:Cl2+H20=2H++C1-+C10-
B.硫酸铝溶液中加入足量氨水:Al3++40H-=[Al(OH)4]-
C.FeS04溶液与稀硝酸反应:3Fe2++NO3-+4H+=3Fe3++NO +2H20
D.碳酸氢铵和足量氢氧化钠溶液反应:NH4++OH-=NH3·H2O
难度: 简单查看答案及解析
-
下列各组离子能够大量共存的是
A. pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42-
B. 水电离出的c(H+)=1×10-13mol·L-1的溶液中:K+、HC03-、Cl-、S2-
C. 使pH试纸显蓝色的溶液中:cu2+、Fe3+、N03-、SO42-
D.在A1C13溶液中:Na+、[Al(OH)4]-、SO42- 、N03- ;
难度: 简单查看答案及解析
-
下列说法正确的是
A.同周期的IIA族与ⅢA族元素的原子序数一定相差1
B.第三周期非金属元素含氧酸的酸性从左到右依次增强
C. 元素的非金属性越强,其气态氢化物水溶液的酸性越强
D.镁、铝、铜、铁、钠五种金属元素中,铜和铁属于过渡元素
难度: 简单查看答案及解析
-
下列说法正确的是
A.0.l mol·L-l的醋酸加水稀释,c(H+)/c(OH-)减小
B. 体积相同、pH相同的醋酸和盐酸完全溶解等量的镁粉,后者用时少
C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大
D. VlLpH=11的NaOH溶液与V2LpH=3的HA溶液混合,若混合液显中性,则V1≤V2
难度: 简单查看答案及解析
-
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-l的盐酸。下列图像能正确表示加入盐酸的体积和生成C02的物质的量的关系的是
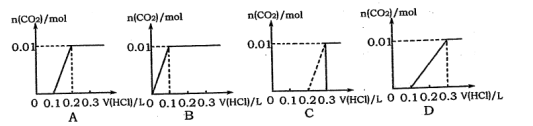
难度: 简单查看答案及解析
-
下列物质的量浓度关系错误的是
A.等物质的量浓度的HA溶液与MOH溶液等体积混合:c(H+)+c(M+)=c(OH-)+c(A-)
B. pH相等的CH3COONa、NaOH和Na2C03三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
c(CH3C00-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1 mol·L-1的NaHC03溶液:c(Na+)>c<OH-)>c(HC03-)>c(H+)
难度: 简单查看答案及解析
-
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应: 3A(g)+2B(g)
4C(g)+D(g),反应2min后达到平衡,测得生成l.6molC,下 列说法正确的是
A.前2min,D的平均反应速率为0.2mol·L-1·min-1。
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡不移动,化学平衡常数不变
D. 增加B,平衡向右移动,B的平衡转化率增大
难度: 简单查看答案及解析