-
下列叙述正确的是( )
A.升高反应的温度,会使反应物的活化能迅速降低
B.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
C.用电解水的方法制取大量氢气可以缓解能源不足的问题
D.推广使用太阳能、风能等能源,有利于缓解温室效应
难度: 中等查看答案及解析
-
下列有关表述正确的是( )
A.次氯酸的电子式:
B.硫原子的价电子排布式:3s23p4
C.氮化硅的分子式:Si4N3
D.N原子的电子排布图为:
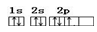
难度: 简单查看答案及解析
-
用VSEPR模型预测下列分子或离子的立体结构,其中正确的是
A.CH4与CH2Cl2均为正四面体 B.BeCl2与SO2为直线形
C.BF3与PCl3为三角锥形 D.NO3—与CO
为平面三角形
难度: 中等查看答案及解析
-
下列措施或事实不能用勒沙特列原理解释的是 ( )
A.滴加酚酞的氨水中加入氯化铵固体后红色变浅
B.棕红色的NO2加压后颜色先变深后变浅(已知: 2NO2 (g)
N2O4 (g))
C.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率
D.用硫酸氢钠去除暖水瓶中的水垢
难度: 中等查看答案及解析
-
下列实验操作所用仪器合理的是 ( )
A. 用广泛pH试纸测得Na2CO3溶液的pH为10.5
B. 用10mL量筒量取5.20mL盐酸
C. 用托盘天平称取25.20gNaCl
D. 用25mL的酸式滴定管量取14.80mL KMnO4溶液
难度: 中等查看答案及解析
-
已知常温下:Ksp(AgCl)=1.6×10-10,下列叙述正确的是 ( )
A.AgCl在饱和NaCl溶液中的Ksp比在纯水中的小
B.AgCl的悬浊液中c(Cl-)=4×10-5.5mol/L
C.将0.001 mol·L-1AgNO3溶液滴入0.001 mol·L-1的KCl,无沉淀析出
D.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr)
难度: 中等查看答案及解析
-
下列关于金属铬的叙述中不正确的是( )
A. 铬元素在周期表中处于第四周期VIB族
B. 铬原子的外围电子层排布为3d44s2
C. 铬原子中,质子数为24
D. 铬元素位于元素周期表的d区,是过渡元素
难度: 简单查看答案及解析
-
用某仪器量一液体体积时,平视时体积为V1ml,仰视读数为V2ml,俯视读数为V3ml,若V3>V1>V2,则所使用的仪器可能是 ( )
A. 容量瓶 B. 量筒 C. 碱式滴定管 D. 以上仪器均可
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A. 增大反应物浓度可以增大活化分子百分数,从而使反应速率增大
B. Li、Be、B三种元素的第一电离能(I1)差别不大,而I2差别很大,则三种原子中最难失去第二个电子的是Be
C. 液氯溶于水后能导电,因此液氯是电解质
D. 固体NH5的所有原子的最外层均满足2个或8个电子的稳定结构,它与水反应的化学方程式为NH5+H2O═NH3•H2O+H2↑
难度: 中等查看答案及解析
-
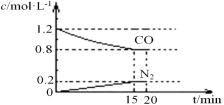
可逆反应∶2NO2
2NO+O2在固定体积密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
少量铁粉与100 mL 0.01 mol·L-1的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)⑧改用10 mL 0.1 mol/L盐酸
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.⑤⑦⑧
难度: 中等查看答案及解析
-
高温下,某反应达到平衡,平衡常数K=
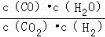 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )A.该反应的焓变为正值
B.恒温下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2O
 CO2+H2
CO2+H2难度: 中等查看答案及解析
-
如下图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g)
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3molA和1molB,则达到平衡时各容器中C物质的体积分数由大到小的顺序为 ( )

A.③②① B.③①② C.①②③ D.②①③
难度: 困难查看答案及解析
-
某反应过程能量变化如图所示,下列说法正确的是 ( )
A.反应过程a有催化剂参与
B.该反应为吸热反应,热效应等于∆H
C.改变催化剂,可改变该反应的活化能
D.有催化剂的条件下,反应的活化能等于E1+E2
难度: 中等查看答案及解析
-
下列各离子组在指定的溶液中一定能大量共存的是 ( )
①常温在C(H+)/C(OH-)= 10-10溶液中:K+、Na+、CH3COO-、SO42﹣
②常温pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③水电离出的H+浓度c(H+)=10﹣12mol•L‾1的溶液中:Cl﹣、NO3﹣、Na+、S2O32﹣
④使甲基橙变红色的溶液中:Fe3+、NO3﹣、Na+、SO42﹣
A.①②③ B.①②④ C.②③④ D.①③④
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述错误的是
A. 含14g硅原子的二氧化硅晶体中含有的硅氧键数目为2NA
B. 3.9g Na2O2晶体中含有0.2NA个离子
C.常温常压下,5g D2O含有的质子数、电子数、中子数均为2.5NA
D. 3mol H2和1mol N2在一定条件下反应所得混合气体分子数大于2NA
难度: 困难查看答案及解析
-
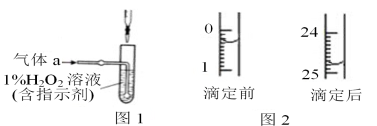
下列实验误差分析结论正确的是 ( )
A. 用润湿的pH试纸测稀酸溶液的pH,测定值偏小
B. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏大
C. 滴定前滴定管内有气泡,终点读数时无气泡,所测体积偏小
D. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大
难度: 中等查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的, W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A. 简单离子半径:W<X<Z B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的沸点:W<Y D. 最高价氧化物的水化物的酸性:Y>Z
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.CS2是极性键构成的极性分子
B.SO2与CO2为等电子体
C.金属晶体的六方最密堆积和面心立方最密堆积的方式空间利用率最高
D.1molNaHSO4熔融态时有3mol离子
难度: 中等查看答案及解析
-
下列有关方程式书写正确的是( )
A.醋酸溶液与氢氧化钠溶液反应的离子方程式为H++OH-=H2O
B.H2S在水溶液中的电离:H2S+H2O
H3O++ HS-
C.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4 (g)+2O2 (g) == CO2 (g)+2H2O (g) ΔH=-890.3 kJ·mol-1
D.双氧水中加入稀硫酸和KI溶液: H2O2+ 2I-+H+
I2+ 2H2O
难度: 中等查看答案及解析
-
某化学科研小组在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g)
cC(g)表示的化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。根据图象,下列判断正确的是( )
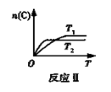
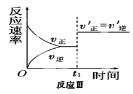

A.反应I:若p1>p2,则此反应只能在高温下自发进行
B. 反应Ⅱ:此反应的ΔH<0,且T1<T2
C.反应Ⅲ:表示t1时刻一定是使用催化剂对反应速率的影响
D.反应Ⅳ:表示t1时刻增大B的浓度对反应速率的影响
难度: 困难查看答案及解析
-
下面提到的问题中,与盐的水解有关的是 ( )
①明矾和FeCl3可作净水剂
②为保存FeCl3溶液,要在溶液中加少量盐酸
③用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
④在NH4Cl溶液中加入金属镁会产生氢气
A.①③④ B.②③ C.全部 D.①②④
难度: 中等查看答案及解析
-
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化)
实验编号
起始浓度/(mol·L-1)
反应后溶
液的pH
c(HA)
c(KOH)
①
0.1
0.1
9
②
x
0.2
7
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
难度: 困难查看答案及解析
-
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)
M(g)+N(g)
实验编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(X)
n(Y)
n(M)
①
700
0.40
0.10
0.090
②
800
0.10
0.40
0.080
③
800
0.20
0.20
a
④
800
0.10
0.10
b
下列说法正确的是 ( )
A.实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率υ(N)=1.0×10-2mol/(L·min)
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为50%
D.实验④中,达到平衡时,b<0.05
难度: 困难查看答案及解析