-
下列与化学反应能量变化相关的叙述正确的是
A.生成物的总能量一定低于反应物的总能量
B.拆开物质中的化学键一定需要吸收能量
C.应用盖斯定律,无法计算某些难以直接测量的反应焓变
D.化学反应都伴随着能量和其他各种现象的出现
难度: 中等查看答案及解析
-
下列各组热化学方程式中,化学反应的△H前者小于后者的是
①C(s)+
O2(g)═CO(g)△H1;C(s)+O2(g)═CO2(g)△H2
②S(g)+O2(g)═SO2(g)△H3;S(s)+O2(g)═SO2(g)△H4
③CaO(s)+H2O(l)═Ca(OH)2(s)△H5;CaCO3(s)═CaO(s)+CO2(g)△H6
A.② B.①② C.①③ D.②③
难度: 中等查看答案及解析
-
对于可逆反应:2SO2+O2
2SO3,下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是
A.增大压强 B.升高温度 C.使用催化剂 D.多充O2
难度: 中等查看答案及解析
-
已知反应:2CO(g)=2C(s)+O2(g)。设△H和△S不随温度而变,下列说法中正确的是
A.低温下是能自发进行 B.高温下能自发进行
C.低温下不能自发进行,高温下能自发进行 D.任何温度下都不能自发进行
难度: 中等查看答案及解析
-
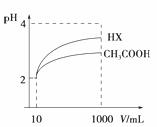
为了说明醋酸是弱电解质,某同学设计了如下实验方案证明,其中错误的是
A.配制0.10 mol/L CH3COOH溶液,测溶液的pH,若pH大于1,则可证明醋酸为弱电解质
B.用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若两者的pH相差小于1个,则可证明醋酸是弱电解质
C.取等体积等浓度的CH3COOH和盐酸溶液,分别加入Na2CO3固体,若醋酸溶液产生气体多,证明醋酸为弱电解质
D.测相同浓度盐酸和醋酸的导电性,醋酸溶液的导电性明显弱于盐酸
难度: 中等查看答案及解析
-
在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g)
C(g)+D(g)已达到平衡状态。①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体的总物质的量 ⑤混合气体总质量
A.①②③ B.②③⑤ C.②③④ D.①③④⑤
难度: 中等查看答案及解析
-
已知反应:①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol 下列结论正确的是
A.碳的燃烧热等于110.5kJ/mol
B.2molC(s)在2molO2(g)燃烧, 放出221kJ热量
C.1L 0.1mol/L硫酸溶液与1L pH=11的NaOH溶液反应,放出5.73kJ热量
D.pH=3的醋酸与pH=11的NaOH溶液反应生成1mol水,放出57.3kJ热量
难度: 中等查看答案及解析
-
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
A.②④⑤⑥ B.①② C.②③⑤ D.②④⑥
难度: 中等查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,分别向1L 0.5mol/L的NaOH溶液中加入:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应时热效应分别为△H1、△H2、△H3,它们的关系正确的是
A.△H1>△H2>△H3 B.△H1>△H3>△H2
C.△H1<△H2<△H3 D.△H1<△H3<△H2
难度: 中等查看答案及解析
-
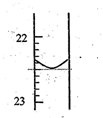
温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)
C(s)+xD(g);△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法不正确的是

A.反应在前10min的平均反应速率v(B)=0.15mol/( L ·min)
B.该反应的平衡常数表达式K=
C.若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动
D.反应至15min时,改变的条件是降低温度
难度: 困难查看答案及解析
-
H+浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是
①反应所需要的时间B>A,
②开始反应时的速率A>B,
③参加反应的锌的物质的量A=B,
④反应过程的平均速率 B>A,
⑤盐酸里有锌剩余 ⑥醋酸里有锌剩余
A.③④⑤ B.③④⑥ C.②③⑤ D.①③⑥
难度: 中等查看答案及解析
-
一定温度下,在三个体积均为2.0L的的恒容密闭容器中发生如下反应:PCl5(g)
PCl3(g)+Cl2(g)
编号
温度(℃)
起始物质的量(mol)
平衡物质的量(mol)
达到平衡所需时(s)
PCl5(g)
PCl3(g)
Cl2(g)
Ⅰ
320
0.40
0.10
0.10
t1
Ⅱ
320
0.80
t2
Ⅲ
410
0.40
0.15
0.15
t3
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器I中的平均速率为v(PCl5)=0.1/t1 mol/(L·s)
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方
向进行
难度: 困难查看答案及解析
-
在一支25mL的酸式滴定管中盛入0.1mol/L-1 HCl溶液,其液面恰好在5mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.1mol/L-1 NaOH溶液进行滴定,则所需NaOH溶液的体积
A.大于20mL B.小于20mL C.等于20mL D.等于5mL
难度: 简单查看答案及解析
-
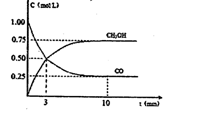
某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)
B(g) + C(g);ΔH = -48.25 kJ.mol-1,反应过程中B、A的浓度比与时间t下图所示关系,若测得第15min时c(B)=1.6 mol.L-1,则下列结论正确的是

A.该温度下此反应平衡常数为3.2
B.A的初始物质的量为4 mol
C.反应达到平衡时,A的转化率为80%
D.反应达到平衡时,放出的热量是193kJ
难度: 困难查看答案及解析
-
已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ/mol、1411.0kJ/mol和1366.8kJ/mol,则由C2H4(g)和H2O(I)反应生成C2H5OH(I)的△H为
A.-44.2kJ/mol B.+44.2kJ/mol C.-241.6kJ/mol D.+241.6/mol
难度: 简单查看答案及解析
-
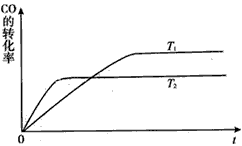
已知可逆反应温度为T0时,在容积固定的密闭容器中发生X(g)+Y(g)
Z(g)(未配平)反应,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应;Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
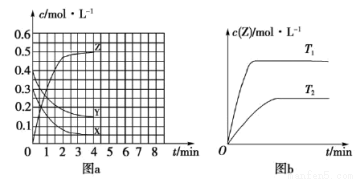
A.发生反应时,各物质的反应速率大小关系为v(X)=v(Y)=2v(Z)
B.图a中反应达到平衡时,Y的转化率为37.5%
C.T0时,该反应的平衡常数为33.3
D.该反应正反应的反应热ΔH<0
难度: 极难查看答案及解析
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+48.0kJ·mol-1
②CH3OH(g)+O2(g)=CO2(g)+2H2(g) △H=-192.9kJ·mol-1
下列说法正确的是
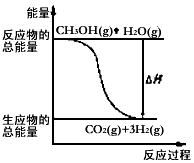
A.CH3OH的燃烧热为192.9kJ·mol-1
B.反应①中的能量变化如上图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(1)+
O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
难度: 困难查看答案及解析
-
可逆反应A(g)+3B(g)
2C(g) △H= -QkJ/mol。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2molC达到平衡后吸收热量为Q2 kJ;已知Q1=3Q2,下列叙述不正确的是
A.甲中A的转化率为75%
B.反应达到平衡前,甲中始终有V正大于V逆,乙中始终有V正小于V逆
C.在该条件下,反应2C(g)
A(g)+3B(g)的平衡常数为27×1.54
D.乙中的热化学方程式为2C(g))
A(g)+3B(g) △H=+Q2kJ/mol
难度: 困难查看答案及解析
-
25℃时,在等体积的下列溶液中,发生电离的水的物质的量之比是
①0.5 mol·L-1的H2SO4溶液,②0.05 mol·L-1的Ba(OH)2溶液,③1 mol·L-1的NaCl溶液,④纯水
A.107∶107∶1∶1 B.1∶10∶107∶107
C.107∶106∶2∶2 D.107∶106∶2×107∶2
难度: 中等查看答案及解析
-
将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应:
2 SO2(g)+ O2(g)
2SO3△H<0。得到如表中的两组数据:
实验编号
温度/℃
平衡常数/mol-1·L
起始量/mol
平衡量/mol
达到平衡所需时间/min
SO2
O2
SO2
O2
1
T1
K1
4
2
x
0.8
6
2
T2
K2
4
2
0.4
y
t
下列说法不正确的是
A.x= 1.6,y=0.2 ,t<6
B.T1、T2的关系:T1 > T2
C.K1、K2的关系:K2>K1
D.实验1在前6min的反应速率υ(SO2)=0.2 mol·L-1·min-1
难度: 极难查看答案及解析