-
甲醇燃料电池被认为是21世纪电动汽车候选动力源
(1)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2
已知H2(g)+ O2(g)=H2O(g) △H =-241.8 kJ·mol-1,则反应②的△H2= 。
O2(g)=H2O(g) △H =-241.8 kJ·mol-1,则反应②的△H2= 。
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) CH3OH(g),现实验室模拟该反应并进行分析,下图是该反应在不同温度下CO的转化率随时间变化的曲线
CH3OH(g),现实验室模拟该反应并进行分析,下图是该反应在不同温度下CO的转化率随时间变化的曲线
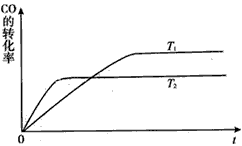
①该反应的焓变△H__________0(填“>” “<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1__________K2(填“>”“<”或“=”)
③现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2,测得CO 和CH 3OH(g)的浓度随时间变化如图所示。
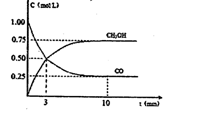
从反应开始到平衡,CO的平均反应速率v(CO)=__________,该反应的平衡常数为K=__________
④恒容条件下,达到平衡后,下列措施中能使n(CH3OH)/n(CO )增大的有__________
A.升高温度 B.充入He(g)
C.再充入1molCO 和3molH2 D.使用催化剂
-
甲醇被称为2l世纪的新型燃料。参考下列图表和有关要求回答问题:
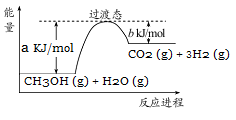
(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O(g)反应生成CO2和H2。上图是该过程中能量变化示意图,请写反应进程CH3OH(g)和H2O(g)反应的热化学方程式 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的另一种反应原理是:
CH3OH(g)+1/2O2(g) = CO2(g)+2H2(g) △H=c kJ/mol
又知H2O(g) = H2O(l) △H=d kJ/mol。
则甲醇燃烧生成液态水的热化学方程式为 。
(3)以CH3OH燃料电池为电源电解法制取ClO2。二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
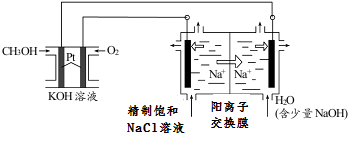
① CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH___________(填“增大”、“减小”、“不变”)。
② 图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取 ClO2。阳极产生 ClO2的反应式为 。电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为______________mol。
③用平衡移动原理解释图中电解池中阴极区pH增大的原因:
-
(7分)德国克莱斯公司成功研制了利用甲醇车载制氢氧燃料电池工艺,其原理如右图所示,请观察此图回答:
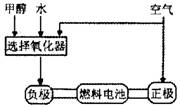
(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H= + 49.0 kJ·mol-1
②2CH3OH(g)+O2(g)=2CO2(g)+4H2(g);△H=-385.8kJ·mol-1
下列说法正确的是
A.反应①中反应物的总能量高于生成物的总能量
B.反应①中拆开CH3OH(g)和H2O(g)中的化学键所需能量大于形成CO2(g)和3H2(g) 中的化学键所释放的能量
C.CH3OH蒸气的燃烧热为大于192.9 kJ·mol-1
D.根据②推知反应:2CH3OH(l)+ O2(g)=2CO2(g)+4H2(g)的△H>-385.8kJ·mol-1
(2)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。若有2.2kg CO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5 kJ的热量,试写出合成塔中发生反应的热化学方程式________。
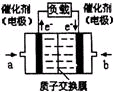
(3)可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如右图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。b处通入的物质是________,负极反应为:________。
-
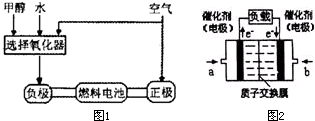
德国克莱斯公司成功研制了利用甲醇车载制氢氧燃料电池工艺,其原理如图1所示,请观察此图回答:
(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ•mol-1
②2CH3OH(g)+O2(g)=2CO2(g)+4H2(g);△H=-385.8kJ•mol-1
下列说法正确的是______
A.反应①中反应物的总能量高于生成物的总能量
B.反应①中拆开CH3OH(g)和H2O(g)中的化学键所需能量大于形成CO2(g)和3H2(g) 中的化学键所释放的能量
C.CH3OH蒸气的燃烧热为大于192.9kJ•mol-1
D.根据②推知反应:2CH3OH(l)+O2(g)=2CO2(g)+4H2(g)的△H>-385.8kJ•mol-1
(2)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇.若有2.2kg CO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式______.
(3)可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如图2.甲醇在催化剂作用下提供质子
(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.b处通入的物质是______,负极反应式为:______.
-
德国克莱斯公司成功研制了利用甲醇车载制氢氧燃料电池工艺,其原理如下图所示,请观察此图回答:
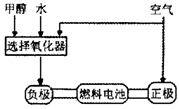
(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ/mol
②2CH3OH(g)+O2(g)=2CO2(g)+4H2(g);△H=-385.8kJ/mol
下列说法正确的是
A.反应①中反应物的总能量高于生成物的总能量
B.反应①中拆开CH3OH(g)和H2O(g)中的化学键所需能量小于形成CO2(g)和3H2(g)中的化学键所释放的能量
C.CH3OH蒸气的燃烧热为大于192.9kJ/mol
D.根据②推知反应:2CH3OH(l)+O2(g)=2CO2(g)+4H2(g)的△H>-385.8kJ/mol
(2)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。若有2.2kg CO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出该反应的热化学方程式__________________。
(3)可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下图。

甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.b处通入的物质是_________,负极反应式为:___________。
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1 = + 49.0 kJ·mol -1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) △H2 =-192.9 kJ·mol -1
下列说法错误的是( )
A.H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收能量
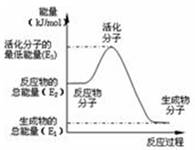
B.反应②中的能量变化如右图所示,则△H2= E1- E2
C.根据②推知,CH3OH的燃烧热△H<-192.9 kJ·mol -1
D.在下图中,加入合适的催化剂,可使E3降低
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
① CH3OH(g) + H2O(g) = CO2(g) + 3H2(g);△H=+49.0 kJ·mol-1
② CH3OH(g) +1/2O2(g) = CO2(g) + 2H2(g);△H=-192.9 kJ·mol-1
下列说法正确的是
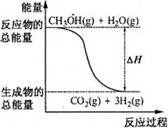
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化可用如右图表示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9 kJ·mol-1
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g) = CO2(g)+3H2(g) △H = + 49. 0 kJ·mol-1②CH3OH(g)+  O2(g) = CO2(g)+2H2(g) △H =-192. 9 kJ·mol-1,下列说法正确的是
O2(g) = CO2(g)+2H2(g) △H =-192. 9 kJ·mol-1,下列说法正确的是
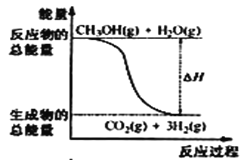
A.CH3OH的燃烧热为192. 9 kJ·mol-1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l) + O2(g) = CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
O2(g) = CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g) = CO2(g)+3H2(g) △H = + 49. 0 kJ·mol-1②CH3OH(g)+  O2(g) = CO2(g)+2H2(g) △H =-192. 9 kJ·mol-1,下列说法正确的是
O2(g) = CO2(g)+2H2(g) △H =-192. 9 kJ·mol-1,下列说法正确的是
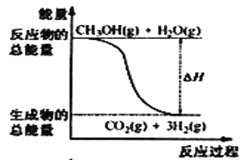
A.CH3OH的燃烧热为192. 9 kJ·mol-1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l) + O2(g) = CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
O2(g) = CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g) = CO2(g)+3H2(g) △H = + 49. 0 kJ·mol-1②CH3OH(g)+  O2(g) = CO2(g)+2H2(g) △H =-192. 9 kJ·mol-1,下列说法正确的是
O2(g) = CO2(g)+2H2(g) △H =-192. 9 kJ·mol-1,下列说法正确的是
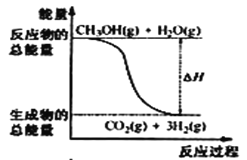
A.CH3OH的燃烧热为192. 9 kJ·mol-1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l) + O2(g) = CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
O2(g) = CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
O2(g)= CO2(g)+2H2(g) △H2
O2(g)=H2O(g) △H =-241.8 kJ·mol-1,则反应②的△H2= 。
CH3OH(g),现实验室模拟该反应并进行分析,下图是该反应在不同温度下CO的转化率随时间变化的曲线













