-
下列各种试剂中:①浓溴水 ②食盐溶液 ③浓H2SO4 ④Na2SO3溶液 ⑤石灰水 ⑥氢硫酸 ⑦Na2SO4溶液,长期放置在空气中不容易变质而浓度变小的组合是:
A.①③④ B.④⑤⑥ C.②④⑦ D.只有①③
难度: 简单查看答案及解析
-
用右图表示的一些物质或概念之间的从属或包含关系中不正确的是
X
Y
Z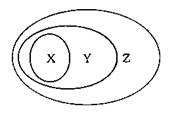
例
氧化物
化合物
纯净物
A
苯
芳香烃
有机化合物
B
溶液
分散系
混合物
C
强电解质
电解质
化合物
D
置换反应
氧化还原反应
离子反应
难度: 简单查看答案及解析
-
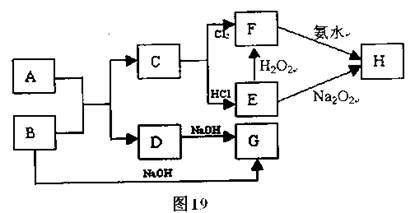
如图所示,6个编号分别代表下列物质中的一种物质,凡是直线相连的两种物质均能发生化学反应(已知高温下氨气能还原氧化铁)。
a. Al;b. Fe2O3;c. NaOH溶液;d. 氢碘酸溶液;e. NH3;f. Cl2。
图中⑤表示的物质是
A.a或b B.c C.d D.e或f
难度: 简单查看答案及解析
-
右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是
 A.该试剂的物质的量浓度为9.2 mol·L—1
A.该试剂的物质的量浓度为9.2 mol·L—1B.该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L
C.配制200 mL 4.6 mol·L—1的稀硫酸需取该硫酸50 mL
D.该硫酸与等体积的水混合所得溶液的质量分数小于49%
难度: 简单查看答案及解析
-
阿伏加德罗常数约为6.02×1023mol—1,下列叙述正确的是
A.标准状况下,22.4 L甲苯所含的分子数约为6.02×1023
B.14g乙烯和丙烯的混合物中,含有共用电子对数目为3×6.02×1023
C.0.1 L 3 mo1·L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023
D.常温常压下,18.0 g重水(D2O)所含的电子数约为10×6.02×1023
难度: 简单查看答案及解析
-
下列对有关实验的描述不正确的是
A.在浓氨水中加入生石灰可以制取少量的NH3
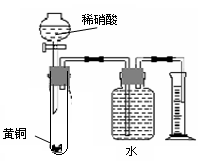 B.用水就可以一次性鉴别溴苯、苯、乙酸三种物质
B.用水就可以一次性鉴别溴苯、苯、乙酸三种物质C.用如图所示的装置可以测定黄铜(Cu、Zn合金)中Zn的含量
D.除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质可以是
H2O、 Ba(OH)2、Na2CO3、HCl
难度: 简单查看答案及解析
-
下列离子方程式,正确的是
A.Ca(ClO)2溶液中通入少量SO2气体:
H2O +SO2 + Ca2+ + 2ClO— === CaSO3↓+ 2HClO
B.向NH4HCO3 溶液中加入足量Ba(OH)2溶液
NH4+ +HCO3— + 2OH— === H2O + CO32— + NH3·H2O
C.向FeCl2溶液中加足量溴水
2Fe2+ + Br2 === 2Fe3++ 2Br—
D.NaAlO2溶液中通入过量CO2
2AlO2— +CO2+3H2O===2Al(OH)3↓+CO32—
难度: 简单查看答案及解析
-
下列除去杂质的方法正确的是
A.除去
中的少量
:通过灼热的CuO粉末,收集气体
B.除去
中的少量HCl:通入
溶液,收集气体
C.除去
溶液中的少量
:加入足量铁屑,充分反应后,过滤
D.除去KCl溶液中的少量
:加入适量NaOH溶液,过滤
难度: 简单查看答案及解析
-
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O
+O2+xOH— Fe3O4+S4O
+2H2O,下列说法中,正确的是:
A.每生成1mol Fe3O4,反应转移的电子总数为3mol B.Fe2+和S2O
都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol D.x=2
难度: 简单查看答案及解析
-
右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的
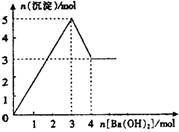 物质的量随Ba(OH)2的物质的量的变化关系。该
物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是
A、MgSO4 B、KAl(SO4)2
C、Al2(SO4)3 D、NaAlO2
难度: 简单查看答案及解析
-
将S02通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色;继续滴人BaC12 溶液,产生白色沉淀。在上述一系列变化过程中,最终被还原的是
A . S02 B . Cl- C . Fe3+ D . N03-
难度: 简单查看答案及解析
-
常温下,测得某无色溶液中由水电离出的C(H+)=1×10-13mol·L-1,则该溶液中一定能共存的离子组是
A.AlO
、NO
、Na+、Cl- B.Mg2+、SO
、Na+、CIO-
C.Fe3+、NO3-、K+、SO
D.Ba2+、K+、NO
、Cl-
难度: 简单查看答案及解析
-
如图所示,夹子开始处于关闭状态,将液体A滴人试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的
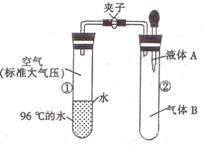
A.氢氧化钠溶液.二氧化碳 B.水.氨气
C.氢氧化钠溶液.一氧化氮 D.水.二氧化氮
难度: 简单查看答案及解析
-
用足量盐酸处理1.68g某合金,放出448mL H2(标准状况下),有0.56g不溶物;用足量NaOH溶液处理该合金时放出896mL H2(标准状况下),有1.12g不溶物。则该合金的组成可能是 A.Al、Fe B.Fe、Si C.Al、Si D.Zn、Fe
难度: 简单查看答案及解析
-
某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;
②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;
③将镁粉放入液溴中,未观察到任何明显现象;
④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。
则下列关于镁与溴水的反应机理的论述中正确的是
A.镁粉只直接与溴水中的溴反应
B.镁粉只与溴水中的酸反应
C.产生极少量的气泡是由于镁粉与水反应得到
D.镁粉在水的催化下与溴发生反应
难度: 简单查看答案及解析
-
某学生设计了如图的方法对A盐进行鉴定:
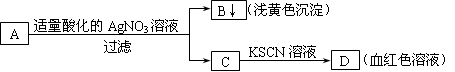
由此分析,下列结论中,正确的是A.A中一定有Fe3+ B.C中一定有Fe3+
C.B为AgI沉淀 D.A一定为FeBr2溶液
难度: 简单查看答案及解析
-
根据下列实验内容得出的结论正确的是
选项
实验内容
结论
A
某物质的水溶液使红色石蕊试纸变蓝
该物质一定是碱
B
某气体能使湿润淀粉碘化钾试纸变蓝
该气体一定是氯气
C
某物质的水溶液中加入盐酸产生无色无味气体
该溶液一定是碳酸根离子
D
0.84g铁和50.00mL 1.00mol/L的稀硝酸反应
反应后溶液中一定有Fe3+和Fe2+
难度: 简单查看答案及解析
-
下列指定粒子的数目相等的是
A.物质的量相等的水与重水含有的中子数
B.等质量的乙烯和丙烯中含有共用电子对数
C.同温、同压、同体积的一氧化碳和乙烯含有的质子数
D.等物质的量和铁和铜分别与氯气完全反应,转移的电子数
难度: 简单查看答案及解析
-
向1mol炽热的Cu2S通入足量的水蒸气,充分反应后生成2mol H2,则Cu2S应转化为
A.Cu和SO2 B.Cu和S C.CuO和SO2 D.Cu2O和S
难度: 简单查看答案及解析
-
一定量的氢气在氯气中燃烧,所得混合物冷却后用500 mL 0.6 mol·L-1的NaOH溶液恰好完全吸收,测得溶液中含有NaClO 0.05 mol,参加反应的氢气和所用氯气的物质的量之比为
A.3︰1 B.3︰2 C.2︰3 D.3︰4
难度: 简单查看答案及解析
-
为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。
根据实验以下推测正确的是
A.一定有SO32-离子 B.一定有CO32-离子
C.一定有C1—离子 D.不能确定HCO3-离子是否存在
难度: 简单查看答案及解析
-
将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
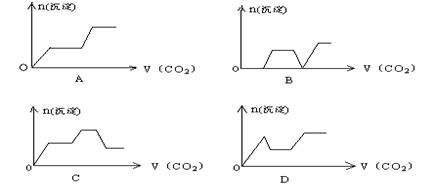
难度: 简单查看答案及解析