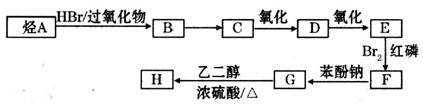
-
下述实验不能达到预期实验目的的是
序号
实验内容
实验目的
A
室温下,使用pH计分别测定浓度均为0.1mol/L NaClO溶液和CH3COONa溶液的PH
比较HClO和
CH3COOH的酸性
强弱
B
将FeCl3溶液分别滴入无色液体苯、CCl4、汽油、AgNO3溶液、Na2S溶液、NaCl溶液、Na2CO3溶液
鉴别物质
C
向0.1mol/LAgNO3溶液中滴加0.1mol/LNaCl溶液,至不再有白色沉淀生成,再向其中滴入0.1mol/L KI溶液,观察沉淀颜色变化。
比较AgCl与AgI溶解度的相对大小
D
向含有少量FeCl3的MgCl2酸性溶液中加入Mg(OH)2,加热并搅拌,过滤。
除去MgCl2酸性溶液含有的少量FeCl3
难度: 中等查看答案及解析
-
常温下,现有0.1mol/L的NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是
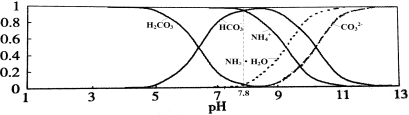
A.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小
C.通过分析可知常温下Kb(NH3·H2O)>Ka1(H2CO3)
D.当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
难度: 困难查看答案及解析
-
已知浓度商(Qc)表示任意状态下反应体系中物质的浓度关系,其表达式与化学平衡常数的表达式相同。保持温度和体积不变,可逆反应:A(s) + 2B(g)
2C(g) + D(g) △H<0, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是
容器
体积
起始物质
平衡时C的
物质的量
平衡时B的
体积分数
平衡常数
甲
1L
1molA+2molB
1mol
φ甲
K甲
乙
1L
4molC+2molD
n1 mol
φ乙
K乙
丙
2L
4molC+2molD
n2 mol
φ丙
K丙
A.在建立平衡的过程中,甲的Qc逐渐减小,乙和丙的Qc逐渐增大
B.K甲=K丙>K乙
C.升高甲的温度,可使φ甲=φ乙
D.n1=1.6,n2=2
难度: 困难查看答案及解析
-
下列有关物质的性质和该性质的应用均正确的是
A.二氧化硫具有还原性,用二氧化硫水溶液吸收溴蒸气
B.氢氟酸具有强酸性,用氢氟酸蚀刻玻璃
C.氨气具有氧化性,用浓氨水检验Cl2管道是否泄漏
D.钠的金属性比钾强,工业上用钠制取钾(Na+KCl
K↑+NaCl)
难度: 简单查看答案及解析
-
下列说法正确的是
A.物质中一定存在化学键
B.酸和碱一定不能发生氧化还原反应
C.正四面体结构的物质的键角均为109º28′
D.晶体中含阴离子必含阳离子,含阳离子不一定含有阴离子。
难度: 简单查看答案及解析
-
下列离子方程式的书写及评价均合理的是
选项
离子方程式
评价
A
将2 mol Cl2通入到含1 mol FeI2的溶液中:
2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2
正确;
Cl2过量,Fe2+、I-均被氧化
B
用Cu电极电解NaCl溶液,阳极的电极反应式:
2Cl--2e-===Cl2↑
正确;
Cl-优先于OH-放电
C
过量SO2通入到NaClO溶液中:
SO2+H2O+ClO-===HClO+HSO3-
正确;
H2SO3的酸性强于HClO
D
Mg(HCO3)2溶液与足量的NaOH溶液反应:
Mg2++2HCO3-+4OH-=== Mg(OH)2 ↓ +
2 CO32-+2 H2O
正确;
Mg(OH)2比MgCO3更难溶
难度: 困难查看答案及解析
-
NA为阿伏加德罗常数,下列叙述正确的是
A.标况下,2.8 L丙烷中含有的极性共价键数为NA
B.在反应KIO3 + 6HI = KI + 3I2 + 3H2O 中,每生成3 mol I2转移的电子数为6 NA
C.已知CH3COONH4溶液的PH=7,则1L 0.1mol/L的CH3COONH4溶液中,CH3COO- 数为0.1NA
D.39g Na2O2和Al(OH)3的混合物中阴、阳离子的总数为2NA
难度: 中等查看答案及解析

 )可由下列路线合成:
)可由下列路线合成: