-
化学与生活是紧密相联的,下列说法正确的是( )
A.地震灾区用漂白粉消毒,是利用漂白粉溶液的碱性
B.鱼、肉、鸡蛋等富含蛋白质的食品被称为碱性食品,长期缺乏可使尿液偏酸性
C.生铁在潮湿的空气中易生锈,其负极反应式为2H2O+O2+4e—===4OH—
D.实验室储存的镁条着火时,不可以用泡沫灭火器灭火
难度: 简单查看答案及解析
-
下列观点你认为正确的是( )
A.某单质固体能导电,该单质一定是金属
B.某化合物的水溶液能导电,该化合物一定是电解质
C.某化合物固态不导电,熔融态能导电,该化合物很可能是离子化合物
D.某纯净物常温常压下为气体,则组成该物质的微粒一定含共价键
难度: 简单查看答案及解析
-
1g 氢气在氧气中完全燃烧生成气态水,放出热量120.9 kJ,则( )
A.反应的热化学方程式:2H2(g)+O2(g)=2H2O(g) ΔH= +483.6 kJ·mol−1
B.氢气的燃烧热为241.8 kJ·mol−1
C.1 mol H2O(1)的能量大于1 mol H2O(g)的能量
D.2 mol H2和1 mol O2的能量总和大于2 mol H2O(g)的能量
难度: 简单查看答案及解析
-
常温下,下列溶液中可能大量共存的离子组是( )
A.水电离产生的c(H+)=1×10-12mol/L的溶液中:AlO2-、S2-、PO43-、Na+
B.加入金属镁能产生H2的溶液中:Na+、HCO3-、SO42-、Al3+
C.能使Al溶解产生H2的溶液中:NH4+、Na+、SiO32-、CO32-
D.含有大量Fe2+的溶液中:K+、Mg2+、ClO-、SO42-
难度: 简单查看答案及解析
-
下列关于有机物的说法正确的是( )
A.乙烯使溴水、酸性高锰酸钾溶液褪色的本质是不同的
B.淀粉、蛋白质、油脂都属于天然高分子化合物
C.聚氯乙烯塑料最适合用来做蔬菜、水果及熟食等的保鲜膜
D.等物质的量的CH4与Cl2恰好反应时,生成CH3Cl与HCl
难度: 简单查看答案及解析
-
能正确表示下列反应的离子方程式的是( )
A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
Ba2+ +2OH− + NH4+ + HCO3− = BaCO3↓+NH3∙H2O + H2O
B.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
C.向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O
D.AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH↓+NH4+
难度: 简单查看答案及解析
-
对下列事实的解释正确的是( )
A.氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性
B.医疗上可用硫酸钡作x射线透视肠胃的内服药,是因为硫酸钡不溶于酸
C.向50mL18mol·L-1 的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45mol
D.常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应
难度: 简单查看答案及解析
-
实验是化学研究的基础。下列关于各实验装置的叙述正确的是( )
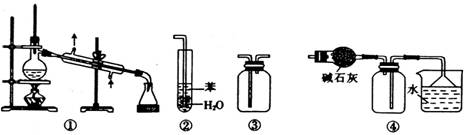
A.装置①常用于分离互不相溶的液体混合物
B.装置②可用于吸收NH3或HCl气体,并防止倒吸
C.装置③可用于收集H2、CO2、Cl2、NH3等气体
D.装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
难度: 简单查看答案及解析
-
下列溶液中微粒浓度关系一定正确的是 ( )
A.将水加热到120℃,pH=6:c(OH—)< c(H+)
B.醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO—)> c(Na+)
C.0.lmoI·L-1的硫酸铵溶液中:c(NH+4)> c(SO2-4)> c(H+)
D.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH—)= c(H+)
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.0.1mol·L-1稀硫酸100mL中含有硫酸根离子个数为0.1NA
B.1molCH3+(碳正离子)中含有电子数为10NA
C.标准状况下,0.5NA 个NO和0.5NA 个O2混合气体的体积约为22.4 L
D.12.4g白磷中含有磷原子数为0.4NA
难度: 简单查看答案及解析
-
下列实验方案能达到预期目的的是( )
①实验室保存FeCl3溶液应加少量稀盐酸,并且放入少量的Fe粉
②氢氧化钠溶液保存在配有橡胶塞的细口瓶中
③向溶液中滴入氯化钡溶液,再加稀硝酸能检验溶液中是否含有SO
④用丁达尔现象可以区分食盐水和淀粉溶液
⑤工业上可用金属铝与V2O5在高温下冶炼矾,铝作还原剂
A.①②④ B.①②⑤ C.②④⑤ D.②③④
难度: 简单查看答案及解析
-
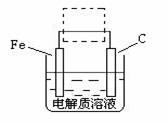
如图是模拟电化学反应装置图。下列说法正确的是( )
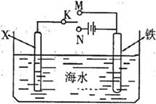
A.若X为碳棒,开关K置于N处,会加快铁的腐蚀
B.若X为锌,开关K置于N处,则X极上有黄绿色气体生成
C.若X为碳棒,开关K置于M处,则铁电极的电极反应式为:Fe-3e-=Fe3+
D.若X为锌,开关K置于M处,则总反应方程式为:2Zn+O2+2H2O=2Zn(OH)2
难度: 简单查看答案及解析
-
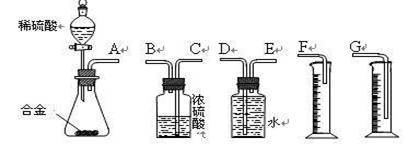
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
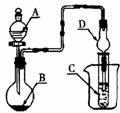
A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊
C.若A为浓硝酸,B为铜,C中盛KI−淀粉溶液,则C中溶液变蓝
D.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
难度: 简单查看答案及解析
-
下表中所示物质或概念间的从属关系一定符合右图的是( )
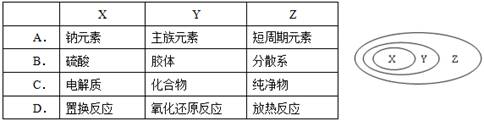
难度: 简单查看答案及解析
-
合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:
N2(g)+3H2(g)
2NH3(g) ;△H< 0 。 400℃、30MPa下n(NH3)和n(H2)随时间变化的关系如图,下列叙述错误的是( )
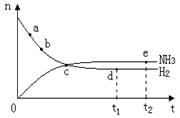
A.点a的正反应速率比b点的大
B.点c处反应还未达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,500℃下反应至t1时刻, n(H2)比右图中d点的值大
难度: 简单查看答案及解析
-
根据表中给出的几种物质的熔、沸点数据,判断下列有关说法中错误的是( )
NaCl
MgCl2
AlCl3
SiCl4
单质B
熔点
810 ℃
710℃
190℃
—68℃
2 300℃
沸点
1465℃
1 418℃
182℃
57℃
2 500℃
A.SiCl4是分子晶体 B.单质B可能是原子晶体
C.AlCl3加热能升华 D.NaCl中键的强度比MgCl2的小
难度: 简单查看答案及解析
-
LiAlH4
、LiH遇水均能剧烈分解释放出H2,LiAlH4在125℃时分解为LiH、H2和Al。下列说法不正确的是( )
A.LiH与D2O反应,所得氢气的摩尔质量为4g/mol
B.1mol LiAlH4 125℃完全分解,转移电子数为3NA
C.LiAlH4溶于适量水得到无色溶液,则化学方程式为:LiAlH4+2H2O== LiAlO2+4H2↑
D.LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂
难度: 简单查看答案及解析
-
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g) + 3H2(g)
2NH3(g) △H=-92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
容器编号
起始时各物质物质的量/mol
平衡时反应中的能量变化
N2
H2
NH3
①
1
3
0
放出热量a kJ
②
2
3
0
放出热量b kJ
③
2
6
0
放出热量c kJ
下列叙述正确的是( )
A.放出热量关系:a < b < 92.4
B.三个容器内反应的平衡常数:③ > ① > ②
C.达平衡时氨气的体积分数:① > ③
D.N2的转化率:② > ① > ③
难度: 简单查看答案及解析
-
CuCO3 和Cu2(OH)2CO3的混合物34.6 g,可恰好完全溶解于300mL、2 mol·L-1的盐酸溶液中,若加热分解等量的这种混合物可得CuO固体质量为( )
A.16.0 g B.19.2 g C.24.0 g D.30.6 g
难度: 简单查看答案及解析
-
钠氯化镍蓄电池是一种新型的电动汽车蓄电池,其正极MCl2中的M代表Ni、Fe、Ca、Cr、Mn、Cu等一系列金属,其中NiCl2的效果最好。而负极的活性物质是液态金属钠。正、负极活性物质被一种只允许Na+迁移的β-Al2O3固体电解质陶瓷管分隔,由于正极是固态多孔金属氧化物,所以还需要添加NaAlCl4熔盐在正极处作第二电解质,在正、负极之间传导钠离子。下列有关钠氯化镍蓄电池的说法错误的是 ( )
A.电池放电时的总反应为2Na+NiCl2===Ni+2NaCl
B.充电时阳极的电极反应为Na++e-===Na
C.放电时正极的电极反应为Ni2++2e-===Ni
D.该电池被称为绿色电池,最大原因是从废弃电池中可以
方便地回收较纯的镍,其他产物对环境没有影响
难度: 简单查看答案及解析
-
铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2
2PbO+2SO2;
③制粗铅:PbO+C
Pb+CO;PbO+CO
Pb+CO2。
下列说法正确的是 ( )
A.浮选法富集方铅矿的过程属于化学变化
B.方铅矿焙烧反应中,PbS是还原剂,发生还原反应
C.过程②中,制取1molPbO共转移2mol电子
D.将1molPbS冶炼成Pb理论上至少需要6g碳
难度: 简单查看答案及解析
-
已知反应:2 E (l)
U (l) 。取等量的E,分别在20℃、50℃测得E的转化率随时间变化的关系曲线(Y-t)如图所示。则下列说法正确的是( )

A.该反应的∆H > 0
B.b代表50℃下E的Y-t曲线
C.m点(66,0.113)时有: ∆n (E,20℃) = ∆n (E,50℃)
D.升高温度可以缩短达到平衡的时间,提高E的转化率
难度: 简单查看答案及解析