-
下列描述,其因果关系成立的是
A.因为NH3的水溶液可以导电,所以NH3是电解质
B.因为SO2可以使溴水褪色,所以SO2具有漂白性
C.因为某碱性溶液的焰色呈黄色,所以其溶质为NaOH
D.因为电解质溶于水后电离为离子,所以电解质在溶液中的反应实质是离子反应
难度: 中等查看答案及解析
-
将CO2转化成有机物,可有效实现碳循环。CO2转化成有机物的例子很多,以下反应中,最节能的是
A.6CO2 + 6H2O
C6H12O6 B.CO2 + 3H2
CH3OH +H2O
C.CO2 + CH4
CH3COOH D.2CO2 + 6H2
CH2=CH2 + 4H2O
难度: 中等查看答案及解析
-
下列有关化学用语的使用正确的是
A.二氧化碳的电子式
B.铝的原子结构示意图
C.甲醛的结构式HCHO D.氧原子的轨道表示式
难度: 中等查看答案及解析
-
下列有机物命名正确的是
A.CH2Br-CH2Br 二溴乙烷
B.
丙氨酸
C.
2,2-二甲基-3-丁醇
D.
硬脂酸甘油脂
难度: 中等查看答案及解析
-
下列说法正确的是
A.酸与碱的反应一定是中和反应 B.醇与酸的反应一定是酯化反应
C.酯的碱性水解就是皂化反应 D.复分解反应一定不是氧化还原反应
难度: 中等查看答案及解析
-
下列说法正确的是
A.单质分子中一定含有共价键
B.离子晶体中一定没有共价键
C.由非金属元素组成的化合物不一定是共价化合物
D.O2、O3、O22-属于同素异形体
难度: 中等查看答案及解析
-
零族元素难以形成化合物的本质原因是
A.它们都是惰性元素 B.它们的化学性质不活泼
C.它们都以单原子分子形式存在 D.它们的原子的电子层结构均为稳定结构
难度: 中等查看答案及解析
-
下列装置可以用作实验室制取乙炔气体的反应装置的是
A.
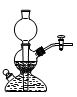 B.
B.C.
D.
难度: 中等查看答案及解析
-
如下图所示,X为铁、Y是石墨电极,a是饱和食盐水,实验开始前,在U形管的两边同时各滴入几滴酚酞试液,下列叙述错误的是
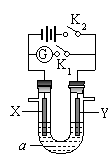
A.合上K1、断开K2,该装置可以将化学能转变为电能
B.合上K1、断开K2,X是阴极,Y电极附近溶液慢慢变为红色
C.合上K2、断开K1,湿润的KI淀粉试纸靠近Y电极管口,试纸变蓝
D.合上K2、断开K1,电解一段时间,X电极附近溶液呈红色
难度: 中等查看答案及解析
-
在下列给定条件的水溶液中,一定能大量共存的离子组是
A.能与铝反应生成H2的溶液:Ca2+、NH4+、HCO3-、Cl-
B.存在大量Fe2+的溶液:H+、Na+、NO3-、SO42-
C.由水电离出的c(H+)=10-12mol/L的溶液:Na+、K+、Cl-、NO3-
D.常温下,c(H+)∶c(OH-)=1×10-12的溶液:K+、Ba2+、ClO-、CO32-
难度: 中等查看答案及解析
-
下列实验设计与结论相符合的是
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘单质萃取到乙醇中
B.某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液显碱性
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定含有SO42-
D.在含FeCl2杂质的FeC13溶液中通足量C12后,充分加热,除去过量的Cl2,即可得到纯净的FeCl3溶液
难度: 中等查看答案及解析
-
已知相同温度下电离常数Ki(HF)>Ki(HCN)。在物质的量浓度均为0.1mol/L的NaCN和NaF混合溶液中,下列关系正确的是
A.c(F-)>c(OH-)>c(HCN)>c(HF) B.c(F-)+c(HF)>c(CN-)+ c(HCN)
C.c(OH-)>c(F-)>c(CN-)>c(H+) D.c(OH-)>c(HF)>c(HCN)>c(H+)
难度: 中等查看答案及解析
-
学习时通过比较、归纳,可以加深对问题的认识。下列比较或归纳一定正确的是
A.稳定性:NH3<PH3<AsH3 B.离子半径:阴离子>阳离子
C.熔沸点:离子化合物>共价化合物 D.酸性:H2SO4>H3PO4>H2SiO3
难度: 中等查看答案及解析
-
易拉罐主要为铝合金,其中以铝铁合金和铝镁合金最为常见。现取几小块易拉罐碎片进行下列实验,其中实验方案与现象、结论正确的是
序号
实验方案
现象、结论
A
加入盐酸
产生无色气体,含铝、铁、镁三种元素
B
加入NaOH 溶液
有无色气体产生,含有铝元素
C
加入盐酸后,所得溶液中再加入少量NaOH溶液
产生白色沉淀,含有镁元素
D
加入KSCN 溶液
溶液呈血红色,含有铁元素
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述中正确的是
A.22.4LN2和NH3混合气体中原子间共有3NA个共用电子对
B.3.0 g甲醛和乙酸混合物中共含碳原子数为0.1NA
C.25℃时pH=1的醋酸溶液中含有H+的数目为0.1NA
D.标准状况下,2.24L CHCl3含有的分子数为0.1NA
难度: 中等查看答案及解析
-
以下物质检验的结论可靠的是
A.往溶液中加入浓溴水,出现白色沉淀,说明含有苯酚
B.往无色溶液中加入氯水,再加CCl4,CCl4层呈红棕色,说明有Br—
C.在制备乙酸乙酯后剩余的反应液中加入碳酸钠溶液,产生气泡,说明还有乙酸剩余
D.将乙醇和浓硫酸共热后得到的气体通入溴水中,溴水褪色,说明生成了乙烯
难度: 中等查看答案及解析
-
往含等物质的量CO32-和HCO3-的溶液中滴入HCl溶液,下列表示产生的气体在标准状况下的体积与加入的HCl溶液体积关系图正确的是
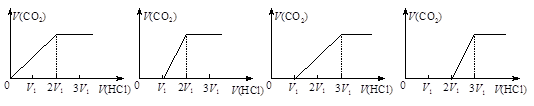 A. B. C. D.
A. B. C. D.难度: 中等查看答案及解析
-
五种短周期元素的原子半径及主要化合价如下表:
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.104
0.111
0.066
主要化合价
+2
+3
+6、¯2
+2
¯2
下列叙述正确的是
A.R与M的单质及其化合物有相似的化学性质
B.L、M的单质均用电解其熔融的盐的方法冶炼而得
C.T的氢化物还原性及稳定性均比Q的氢化物强
D.五种元素的常见简单离子中半径最大的是Q2-
难度: 中等查看答案及解析
-
下列实验操作,其中正确的是
A.蒸发操作时,应将溶液放入坩埚中加热,直到完全蒸干后停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
难度: 中等查看答案及解析
-
香柠檬油可用于化妆品。香柠檬油含微量的香柠檬酚和香柠檬醚,其结构如下图。下列说法正确的是
A.香柠檬醚的分子式为C13H9O4
B.香柠檬醚最多可与7molH2发生加成反应
C.1mol香柠檬酚与Br2发生取代反应,最多消耗3mol Br2
D.1mol香柠檬酚与NaOH溶液反应,消耗3molNaOH
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.在稀氨水中通入过量CO2:NH3·H2O+CO2→NH4++HCO3-
B.向次氯酸钠溶液中通入少量的CO2:2ClO-+H2O+CO2→2HClO+CO32-
C.用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+→Cu2++2H2O
D.NH4HSO4溶液中加入足量Ba(OH)2溶液:H++SO42-+Ba2++OH-→BaSO4↓+H2O
难度: 中等查看答案及解析
-
0.035mol铜完全溶于硝酸,产生氮的氧化物(NO、NO2、N2O4)混合气体共0.05mol。该混合气体的平均相对分子质量可能是
A.30 B.42 C.45 D.60
难度: 中等查看答案及解析