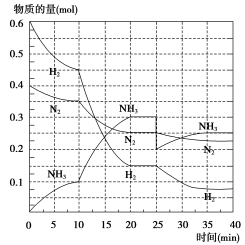
-
下列是4位同学在学习“化学反应速率与化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
难度: 中等查看答案及解析
-
下列各图所反映的措施中,目的是为了加快其化学反应速率的是

难度: 中等查看答案及解析
-
反应4NH3+5O2
4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是
A.v(O2)=0.125mol·(L·s)-1 B.v(NO)=0.01mol·(L·s)-1
C.v(NH3)=0.01 mol·(L·s)-1 D.v(NH3)=0.2 mol·(L·s)-1
难度: 简单查看答案及解析
-
在恒温、恒容条件下,能使A(g)+B(g)
C(g)+D(g)正反应速率增大的措施是
A.减小C或D的浓度 B.充入“惰性气体”
C.减小B的浓度 D.升高温度
难度: 中等查看答案及解析
-
下列说法正确的是
A.增大压强,活化分子数增多,化学反应速率一定增大
B.升高温度,活化分子百分数不一定增大,化学反应速率一定增大
C.加入反应物,使活化分子百分数增加,化学反应速率增大
D.使用催化剂,降低反应的活化能,增大了活化分子百分数,化学反应速率一定增大
难度: 中等查看答案及解析
-
在恒温、恒容的容器中进行反应:2HI
H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为
A.等于10 s B.等于12 s C.大于12 s D.小于12 s
难度: 中等查看答案及解析
-
100ml 6mol/L硫酸与52g锌粒反应,在一定温度下为了减缓反应的速率,但又不影响生成氢气的总量,可向反应物中加入
A.少量碳酸钠固体 B.少量硫酸铜固体
C.硝酸钾溶液 D.氯化钠溶液
难度: 中等查看答案及解析
-
关于化学平衡常数的叙述,正确的是
A.只与化学反应方程式本身和温度有关
B.只与反应的温度有关
C.与化学反应本身和温度有关,并且会受到起始浓度的影响
D.只与化学反应本身有关,与其他任何条件无关的一个不变的常数
难度: 中等查看答案及解析
-
在恒温恒容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)
C(g)+D(g)已达到平衡状态
①混合气体的压强
②混合气体的密度
③B的物质的量浓度
④混合气体的总物质的量
⑤混合气体的平均相对分子质量
⑥v(C)与v(D)的比值
⑦混合气体的总质量
⑧混合气体的总体积
A.①③④⑤ B.①②③④⑤⑦
C.①③④⑤⑧ D.①②③④⑤⑥⑦⑧
难度: 中等查看答案及解析
-
在容积固定的密闭容器中存在如下反应:A(g)+3B(g)
2C(g) ΔH<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:下列判断一定错误的是

A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且乙的压强较高
C.图Ⅲ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅳ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
难度: 困难查看答案及解析
-
在密闭容器中进行如下反应:X2(g)+Y2(g)
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度不可能的是
A.Z为0.3 mol·L-1
B.X2为0.15 mol·L-1,Z为0.1 mol·L-1
C.c(X2)+c(Y2)+c(Z)=0.6 mol·L-1
D.c(X2)+c(Y2)+c(Z)=0.55 mol·L-1
难度: 中等查看答案及解析
-
1000 K时反应 C(s)+2H2(g)
CH4(g)的K=0.5,当各气体物质的量浓度分别为H2 0.7 mol·L-1、CH4 0.2 mol·L-1时,上述反应
A.正向移动 B.逆向移动 C.达到平衡 D.不一定
难度: 简单查看答案及解析
-
如图所示是温度和压强对X+Y
2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是

A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种为气态、Z为气态
D.上述反应的逆反应的ΔH>0
难度: 中等查看答案及解析
-
已知反应mX(g)+nY(g)
qZ(g)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
难度: 中等查看答案及解析
-
汽车尾气净化中的一个反应如下:
NO(g)+CO(g)
N2(g)+CO2 (g) ΔH=-373.4 kJ·mol-1
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
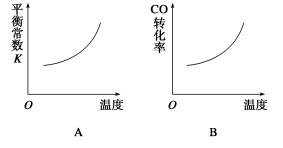
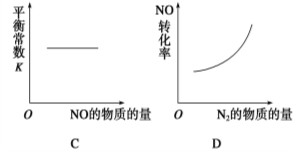
难度: 中等查看答案及解析
-
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)===Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
C.反应至4 min时若HCl浓度为0.12 mol·L-1,则H2反应速率为0.03 mol·L-1·min-1
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液中恰好反应
难度: 中等查看答案及解析
-
在一定温度下,将CO和水蒸气分别为1 mol、3 mol,在密闭容器中反应: CO+H2O(g)
CO2+H2,达到平衡后测得CO2为0.75 mol,再通入6 mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和可能为
A.1.2 mol B.1.5 mol C.1.8 mol D.2.5 mol
难度: 中等查看答案及解析
-
根据下列有关图象,说法正确的是

A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的ΔH<0
B.由图Ⅱ知,反应在t6时刻,NH3体积分数最大
C.由图Ⅱ知,t3时采取增大反应体系压强的措施
D.若图Ⅲ表示在10 L容器、850℃时的反应,由图知,到4 min时,反应放出51.6 kJ的热量
难度: 困难查看答案及解析
-
取五等份NO2 分别加入温度不同、容积相同的恒容密闭容器中,发生反应: 2NO2(g)
N2O4(g) ΔH<0反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
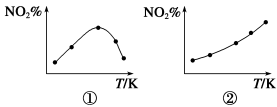
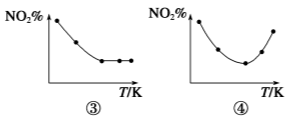
A.①② B.①④ C.②③ D.②④
难度: 困难查看答案及解析
-
体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g)
2SO3(g)并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
A.等于p% B.大于p% C.小于p% D.无法判断
难度: 中等查看答案及解析