-
未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生。下列属最有希望的新能源的是( )
① 天然气②煤③核能④水电⑤太阳能⑥燃料电池⑦风能⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③④⑤⑥ D.除①②外
难度: 简单查看答案及解析
-
下列物质间的反应,其能量变化符合图示的是( )

A.锌和稀盐酸反应制取氢气
B.灼热的碳与二氧化碳反应
C.碳酸钙的分解
D.Ba(OH)2·8H2O晶体和NH4Cl晶体混合
难度: 简单查看答案及解析
-
在铁制品上镀上一定厚度的锌层,以下电镀方案中正确的是( )
A 锌作阳极,铁制品作阴极,溶液中含Fe2+
B 锌作阴极,铁制品作阳极,溶液中含Zn2+
C 锌作阴极,铁制品作阳极,溶液中含Fe3+
D 锌作阳极,铁制品作阴极,溶液中含Zn2+
难度: 简单查看答案及解析
-
对于化学反应3W(g)+2X(g)===4Y(g)+3Z(g),下列反应速率关系中,正确的是( )
A.v(W)=3v(Z) B.2v(X)=3v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)
难度: 简单查看答案及解析
-
下列关于判断过程方向的说法正确的是( )
A.所有自发进行的化学反应都是放热反应
B.高温高压下可以使石墨转化为金刚石是自发的化学反应
C.由焓判据和熵判据组合而成的复合判据,将更适合于所有的过程
D.同一物质的固、液、气三种状态的熵值相同
难度: 简单查看答案及解析
-
科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机酸转化成氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为( )
A.H2+2OH-―→2H2O+2e-
B.O2+4H++4e-―→2H2O
C.H2―→2H++2e-
D.O2+2H2O+4e-―→4OH-
难度: 简单查看答案及解析
-
下列有关原电池叙述正确的是( )
A.原电池是将化学能转变成电能的装置
B.在原电池中失去电子的一极是阴极
C.原电池的两极一定是由活动性不同的两种金属组成
D.原电池的负极发生的是还原反应
难度: 简单查看答案及解析
-
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④
C.②③ D.③④
难度: 简单查看答案及解析
-
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)
zC(g)。平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断错误的是 ( )
A.x+y<z B.平衡向逆反应方向移动
C.B的转化率降低 D.C的体积分数下降
难度: 简单查看答案及解析
-
下列与化学反应能量变化相关的叙述正确的是( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
难度: 简单查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)是制备硫酸的重要反应。下列叙述正确的( )
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为 v=
难度: 简单查看答案及解析
-
合成氨反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如下图: 下列说法正确的是( )

A.t1时降低了温度 B.t2时使用了催化剂
C.t3时增大了压强 D.t4时降低了温度
难度: 简单查看答案及解析
-
在一定条件下,对于反应mA(g)+nB(g)
cC(g)+dD(g),C物质的百分含量(C%)与温度、压强的关系如图所示,下列判断正确的是( )

A.ΔH<0 ΔS>0 B.ΔH>0 ΔS<0
C.ΔH>0 ΔS>0 D.ΔH<0 ΔS<0
难度: 简单查看答案及解析
-
在密闭容器进行如下反应:
已知X1、Y2、Z的起始浓度分别为
,在一定条件下当反应达到平衡时,各物质的浓度有可能( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为( )
A. C + H2O == CO + H2 ; ΔH== +131.3KJ·mol—1
B. C(s)+ H2O(g) == CO(g) + H2(g) ; ΔH== +10.94KJ·mol—1
C. C(s)+ H2O(l) == CO(g) + H2(g) ; ΔH== +131.3KJ·mol—1
D. C(s)+ H2O(g) == CO(g) + H2(g) ; ΔH== +131.3KJ·mol—1
难度: 简单查看答案及解析
-
把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图所示。最先观察到酚酞变红的现象的区域是( )

A.I和III B.I和IV C.II和III D.II和IV
难度: 简单查看答案及解析
-
某原电池总反应离子方程式为:2Fe3+ +Fe == 3 Fe2+,能实现该反应的原电池是( )
A 正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
B 正极为Cu,负极为Fe,电解质溶液为Fe(NO3)2溶液
C 正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液
D 正极为Ag,负极为Fe,电解质溶液为CuSO4溶液
难度: 简单查看答案及解析
-
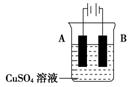
用惰性电极电解CuSO4溶液一段时间后,欲使溶液恰好恢复至电解前情况,可加入的物质是( )
A.CuSO4 B.Cu(OH)2 C.Cu D.CuO
难度: 简单查看答案及解析
-
有X、Y、Z、M四种金属,已知:X可以从Y 的盐溶液中置换出Y;X和Z作原电池电极时,Z为正极;Y和Z的离子共存于电解液中,Y离子先放电;M的离子的氧化性强于Y的离子,则这四种金属的活动性由强到弱的顺序是( )
A.X 〉Y〉Z〉M B. X 〉Z〉M〉Y
C. M 〉Z〉X〉Y D. X 〉Z〉Y〉M
难度: 简单查看答案及解析
-
NO和CO都是汽车尾气里的有害物质,有人提出通过以下反应来处理尾气:
2NO(g ) + 2CO(g ) =N2 (g ) + 2CO2 (g )。 对上述反应,下列看法正确的是( )
A.使用催化剂能加快反应速率
B.改变压强对反应速率没有影响
C.冬天气温低,反应速率降低,对人体危害较小
D.无论外界条件怎样改变,均对此化学反应的速率无影响
难度: 简单查看答案及解析
 ,恒容时,温度升高H2浓度减小。试回答下列问题:
,恒容时,温度升高H2浓度减小。试回答下列问题: