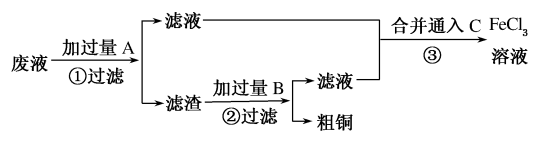
-
下面是有关厨房中的常见操作或常见现象,其中不属于氧化还原反应的是
A.烧菜用过的铁锅,经放置常出现红棕色斑迹
B.用气灶燃烧沼气(主要成分为甲烷)为炒菜提供热量
C.牛奶久置变质腐败
D.氧化铜固体加入稀盐酸中,完全溶解
难度: 简单查看答案及解析
-
表中对于相关物质的分类全部正确的一组是
编号
纯净物
混合物
碱性氧化物
非电解质
A
液氯
漂白粉
Al2O3
CO
B
冰醋酸
浓硫酸
Na2O2
乙醇
C
碱石灰
王水
K2O
Cl2
D
胆矾
水玻璃
CaO
SO2
难度: 中等查看答案及解析
-
下列说法中不正确的是
A.Al2O3可用作耐火材料,硅酸钠是制备木材防火剂的原料
B.碳素钢的主要成分是铁碳合金、司母戊鼎的主要成分是铜合金
C.“海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化
D.绚丽缤纷的烟花中添加了含钾,钙,钠,铜等金属元素化合物
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值,下列说法正确的是
A.2.8g铁与0.05mol Cl2充分反应,转移0.15NA电子
B.27g Al与足量NaOH溶液反应生成 33.6L H2
C.14g由乙烯(C2H4)和丙烯(C3H6)组成的混合物中含有原子的数目为3NA
D.0.1mol Na2O2与足量二氧化碳反应转移0.2NA个电子
难度: 困难查看答案及解析
-
下列说法不正确的是
A.用小苏打(NaHCO3)发酵面团制作馒头
B.干燥的氯气和液氯均能使干燥的有色布条褪色
C.用Al(OH)3治疗胃酸过多
D.光导纤维的主要成分是SiO2
难度: 简单查看答案及解析
-
将某些化学知识用图像表示,可以收到直观、简明的效果。下列图象所表示的化学知识中,
明显不正确的是
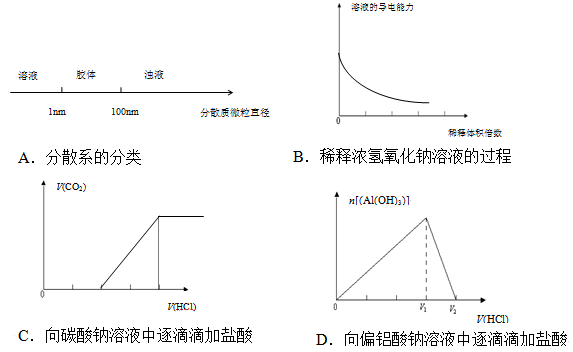
难度: 困难查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.在透明的溶液中:Na+ 、K+、MnO4-、CO32-
B. pH>7的溶液中:Fe2+、Cu2+、SO42-、Cl-
C.有SO42-存在的溶液中:K+ 、Mg2+、Ag+、NO3-
D.加入金属铝产生H2的溶液中:NH4+、Na+、SO42-、CH3COO-
难度: 中等查看答案及解析
-
用下图所示装置能达到有关实验目的是

A.用甲图装置证明密度ρ(苯)<ρ(钠)<ρ(水)
B.用乙图装置分离酒精和四氯化碳
C.用丙图装置干燥Cl2
D.用丁图装置比较NaHCO3和Na2CO3的热稳定性
难度: 中等查看答案及解析
-
下列有关叙述正确的是
A.相同条件下,质量相等的CO和CO2它们所含的氧原子数目之比为11:7
B.同体积、同密度的C2H4和CO,两种气体的分子数一定相等
C.配制450 mL 0.1 mol·L-1的NaOH溶液,用托盘天平称取NaOH固体1.8 g
D.1 L 0.45 mol·L-1 NaCl溶液中Cl-的物质的量浓度比0.1L 0.15 mol·L-1 AlCl3溶液大
难度: 中等查看答案及解析
-
下列有关除杂方法正确的是
A.除去Fe3+中Al3+:加入过量氨水充分反应后,过滤
B.除去FeCl3 中少量CuCl2:用足量的铁粉,过滤
C.除去石英中的碳酸钙:用足量稀盐酸溶解后,过滤
D.除去铝粉中的镁粉:加入足量的氢氧化钠溶液后,过滤
难度: 简单查看答案及解析
-
在下列各溶液中逐渐通入CO2气体直至过量,会出现沉淀先产生后消失现象的是
①饱和Na2CO3溶液 ②澄清石灰水 ③Ca(ClO)2溶液 ④CaCl2溶液 ⑤Na2SiO3溶液 ⑥NaAlO2溶液
A.全部 B.只有③⑥ C.除①⑤⑥ D.只有②③
难度: 简单查看答案及解析
-
实验室可用K2Cr2O7固体与浓盐酸混合加热制备氯气。发生的离子反应如下:
____Cr2O72-+____Cl-+____H+=____Cl2↑+ ____Cr3++____
,下列有关叙述不正确的是
A.以上各物质对应的计量数依次为1、6、14、3、2、7
B.Cr2O72-发生了还原反应
C.
处对应的物质是H2O
D.若0.1mol Cr2O72-参加反应,产生氯气物质的量是0.5mol
难度: 困难查看答案及解析
-
下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验提供的试剂:铁屑、6 mol/L硫酸溶液、NaOH溶液。下列说法错误的是

A.B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑
B.实验开始时应先将活塞E关闭
C.生成Fe(OH)2的操作为:关闭E,使A中溶液压入B瓶中
D.取下装置B中的橡皮塞,使空气进入,有关反应的化学方程式为:
4Fe(OH)2 + O2 + 2H2O=4Fe(OH)3
难度: 困难查看答案及解析
-
下列离子方程式正确的是
A.向明矾溶液中加入氢氧化钡溶液至沉淀的物质的量达到最大值:
Al3++ 2SO42-+ 2Ba2++ 4OH-=2BaSO4↓+ AlO2-+2H2O
B.向澄清石灰水中通入少量CO2:OH- + CO2=HCO3-
C.醋酸溶液与水垢中的CaCO3反应:CaCO3 + 2CH3COOH=Ca2++ 2CH3COO-+H2O + CO2↑
D.硝酸银溶液中加入铜粉:Ag+ + Cu=Cu2+ + Ag
难度: 困难查看答案及解析
-
某混合物的水溶液中可能含有以下离子中的若干种:Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-,现分别取100 mL的两份溶液进行如下实验。
①第一份加过量NaOH溶液后加热,收集到0.03 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,过滤后的沉淀经足量盐酸洗涤、干燥后,得到23.3g固体,向滤液中加入AgNO3溶液又有白色沉淀产生。下列有关叙述正确的是
A.由①可知原溶液存在离子为NH4+,其浓度为0.03mol/L
B.原溶液肯定没有Fe3+、Mg2+,一定含有Na+
C.n(NH4+):n(Al3+):n(SO42-)=3:1:10
D.原溶液一定存在Cl-
难度: 困难查看答案及解析
-
取3.38g K2CO3和KHCO3的混合物溶于水配成25 mL溶液,往溶液中加入25 mL Ba(OH)2溶液恰好使生成白色沉淀的量最多。反应后溶液的c(OH-)=0.8mol/L(忽略混合后溶液体积变化)。则原混合物中K2CO3和KHCO3 物质的量之比为
A.1:2 B.1:1 C.2:1 D.2:3
难度: 困难查看答案及解析