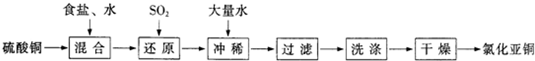
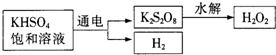
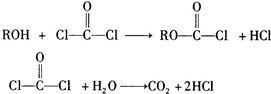-
化学在科学与社会发展中有着重要作用,下列叙述不正确的是( )
A.从舍勒发现氧气到戴维的确认,历经30多年,说明科学研究是艰辛的
B.硅和二氧化硅都可作光导纤维材料
C.海水通过蒸馏可得到淡水,通过蒸发可得到粗盐
D.燃煤使用前,先进行脱硫处理,体现了“绿色化学”思想难度: 中等查看答案及解析
-
下列说法:①只含一种元素的物质一定是纯净物 ②BaSO4是一种难溶于水的强电解质③冰醋酸、烧碱、小苏打分别属于酸、碱、盐,其中正确的是( )
A.①②③
B.①③
C.②③
D.①②难度: 中等查看答案及解析
-
下表中,对第Ⅰ、Ⅱ栏判断都正确的是
第Ⅰ栏 第Ⅱ栏 判断 A. 铁与稀硫酸反应可生成氢气 铁丝在氧气中点燃生成Fe3O4 Ⅰ对;Ⅱ对 B. Na2CO3溶液中,c(Na+)=2c(CO32-) 21H原子的中子数和质子数相等 Ⅰ对;Ⅱ错 C. Na2O2与H2O反应的化学方程式为
Na2O2+H2O=2NaOH+O2↑常温下可用铝罐贮存浓硝酸 Ⅰ对;Ⅱ对 D. 用AgNO3溶液和稀硝酸可区分Na2CO3、NaBr溶液 25℃时,改变醋酸溶液的浓度,醋酸的电离平衡常数也改变 Ⅰ对;Ⅱ对
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
A、B、C三种短周期元素在周期表中位置如图示,B位于ⅥA族.下列叙述错误的是( )
A.原子半径大小顺序为B>A>C
B.非金属性强弱顺序为B>C>A
C.BO2与H2B在常温下可发生反应
D.A的氢化物水溶液呈碱性难度: 中等查看答案及解析
-
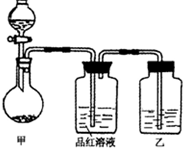
下列实验设计合理的是( )
A.除去粗盐中的Ca2+、Mg2+、SO42-,依次加入H2O和Na2CO3、Ba(OH)2、HCl溶液
B.
如图所示装置能用于测量气体的体积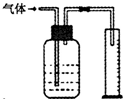
C.用pH试纸可测某新制氯水的pH
D.航海船只的船底四周镶嵌锌块来保护船体难度: 中等查看答案及解析
-
下列有关有机化合物的说法正确的是( )
A.用水可以区分乙酸乙酯和苯
B.有机物分子中都存在碳碳单键
C.聚乙烯属于高分子化合物
D.乙醇、油脂、淀粉是人们必需的营养物难度: 中等查看答案及解析
-
下列说法正确的是( )
A.1L 1mol/L FeCl3溶液中含有Fe3+的数目为阿伏加德罗常数的值
B.与Al反应生成H2的无色溶液中,一定可以大量存在Na+、NO3-、Cl-、NH4+
C.用铂电极电解CuSO4溶液片刻,停止通电,若加入一定质量Cu(OH)2可得初始溶液
D.1 mol CH4在反应①与②中,转移的电子数相同①CH4+4NO2=4NO+CO2+2H2O ②CH4+4NO=2N2+CO2+2H2O难度: 中等查看答案及解析