-
下列元素在自然界中都以化合态存在的是( )
①钠 ②铝 ③铁 ④硅 ⑤氯
A. ①②③ B. ①④⑤ C. ①②③④⑤ D. ①②③④
难度: 简单查看答案及解析
-
下列实验操作中正确的是( )
A. 蒸发操作时,应使混合物中的水分完全蒸干后才能停止加热
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处
C. 分液操作时,分液漏斗中下层液体从下口放出后,再将上层液体从下口放出到另一个烧杯
D. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数,下列说法正确的是( )
A. 0.1mol Na2O2固体与足量的H2O充分反应,转移0.2NA个电子
B. 1 L 0.1 mol/L NaHSO4溶液中含有0.1 NA个HSO4-
C. 标准状况下,11.2 L CCl4含有的分子数为0.5NA
D. 常温常压下,23 g NO2和N2O4的混合气体一定含有NA个氧原子
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 向沸水中逐滴加入少量饱和FeCl3溶液,可制备(FeOH)3胶体
B. CO2的水溶液可以导电,所以CO2是电解质
C. 根据丁达尔效应可将分散系分为溶液、胶体和浊液
D. 强电解质的溶液导电能力一定强于弱电解质的溶液
难度: 简单查看答案及解析
-
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
选项
陈述Ⅰ
陈述Ⅱ
A
Na2O2能与水反应
Na2O2可用来作呼吸面具
B
铝比铁活泼
铝比铁更容易被腐蚀
C
钠与水反应是放热反应
与水反应时,钠熔化为小球
D
晶体硅熔点高硬度大
可用于制作半导体材料
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列离子方程式的书写正确的是( )
A. 大理石溶于醋酸中:CaCO3+CH3COOH=Ca2++CH3COO-+CO2↑+H2O
B. 少量NaHCO3溶液与Ba(OH)2溶液反应:Ba2++OH-+HCO3-=BaCO3↓+H2O
C. 将Na投入到CuSO4溶液中:2Na+Cu2+=2Na++Cu
D. 将Cl2通入水中:Cl2+H2O=2H++Cl-+ClO-
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 某物质焰色反应为黄色,该物质中一定不含K元素
B. 合金的熔点一定比各成分金属的都高
C. SiO2属于酸性氧化物,不与任何酸反应
D. 氢氧化铝具有弱碱性,可用于制胃酸中和剂
难度: 中等查看答案及解析
-
在硫酸铁溶液中,加入铜粉至完全溶解后,又加入一定量铁粉,充分反应后有残余固体,则下列判断正确的是( )
A. 残余固体可能为铁、铜混合物 B. 最后得到的溶液中含有Fe3+
C. 最后得到的溶液中只含Cu2+ D. 残余固体一定全部是铜
难度: 中等查看答案及解析
-
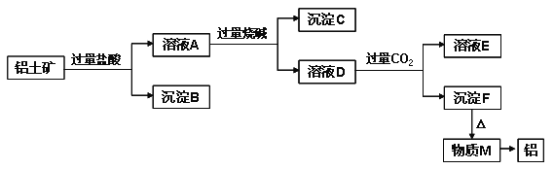
甲、乙、丙、丁是中学化学常见的物质,且甲、乙、丙均含有同一种元素。甲、乙、丙、丁之间的转化关系如右图所示,则乙不可能是( )
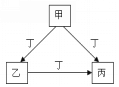
A. Al(OH)3 B. FeCl3 C. CO D. Na2CO3
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中可能大量共存的是
A. FeCl3溶液中:K+、Na+、SO42-、SCN-
B. 使酚酞试液变红的溶液中:NH4+、Na+、HCO3-、NO3-
C. 漂白粉溶液中:K+、Na+、I-、CO32-
D. 与铝反应产生氢气的溶液中:Na+、K+、CO32-、OH-
难度: 中等查看答案及解析
-
某溶液中含有Fe2+和I-。为了氧化I-而不使Fe2+被氧化,试根据下列三个反应判断,可选用的氧化剂是( )
①2Fe3++2I-=2Fe2++I2 ②2Fe2++Cl2=2Fe3++2Cl- ③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
A. FeCl2 B. KMnO4 C. Cl2 D. FeCl3
难度: 中等查看答案及解析
-
由于Cl2对饮用水消毒,生成的有机氯化物对人体有害。世界环保联盟建议使用ClO2,它是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:KClO3+H2C2O4+H2SO4—— ClO2↑+K2SO4+CO2↑+H2O(未配平)。下列说法正确的是( )
A. KClO3在反应中是还原剂
B. 1 mol KClO3参加反应,在标准状况下能得到22.4 L气体
C. ClO2消毒的效率(以单位质量得到电子数表示)是Cl2的约5.3倍
D. 1 mol KClO3参加反应有1 mol电子转移
难度: 中等查看答案及解析
-
下列除杂方式正确的是( )
A. CO2气体中含有的少量杂质HCl可通过饱和Na2CO3溶液除去
B. MgO粉末中含有少量的Al2O3可加入NaOH溶液过滤除去
C. Na2CO3溶液中含有少量的NaHCO3可用加热的方式提纯
D. Cu粉中含有的少量杂质Fe可加入FeCl3溶液除去
难度: 中等查看答案及解析
-
一定条件下,当溶液中XO4-与H2O2分子个数比恰好为2︰5时,溶液中XO4-离子被还原为
较低价态,则X元素的化合价变为
A. +2 B. +3 C. +4 D. +5
难度: 中等查看答案及解析
-
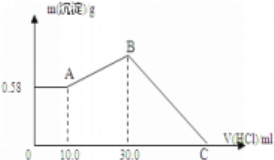
某两种金属单质的混合物 4g 与足量 Cl2 充分反应,生成氯化物的质量为 Wg,并且(W-4)g 为 7.1g, 则该两种金属可能( )
A. Cu、Zn B. Na、Zn C. Fe、Cu D. Fe、Al
难度: 困难查看答案及解析
-
向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系不正确的是( )
A. n=17Vc+m B. 5m/3<p<17m/9
C. p=m+cV/125 D. c=1000b/11.2V
难度: 困难查看答案及解析