-
(14分)汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化一还原法消除NOx的转化如下:
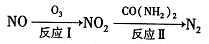
①反应I为NO +O3=NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,氧化产物与还原产物的质量比为______
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+ NOx →N2 +CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数比为 。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式 .
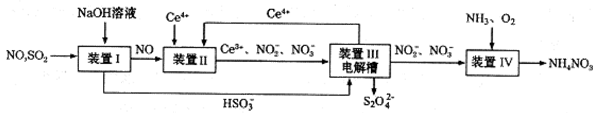
(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的 (填“阳极”或“阴极”),同时在另一极生成S2O42一的电极反应式为 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为ag.L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通人标准状况下的氧气 L(用含a代数式表示,结果保留整数)。
难度: 极难查看答案及解析
-
(14分)工业上由焦炭或夭然气制氢气的过程中会产生一氧化碳。为了除去氢气中混有的一氧化碳,可在催化剂存在的条件下将一氧化碳与水蒸气发生反应:
CO(g)+H2O(g)
CO2(g)+H2(g) △H=-41.0 kJ·mol-l .
该反应在工业上被称为“一氧化碳变换”。
(1)写出该反应的平衡常数表达式:K= ;K ( 200℃ ) K ( 300℃ ) (填 “>”、“=”或“<”)。
(2)在773K时,一氧化碳发生反应的平衡常数K=9,如反应开始时CO和H2O的浓度都是0.020·mol-l ,则在此反应条件下一氧化碳的转化率为 。
(3)某工业合成氨的原料气组成为:H2 40%、N2 20%、CO 30%、CO210%(均为体积分数)。现采用“一氧化碳变换”法,向上述原料气中加入水蒸气,以除去其中的CO。已知不同温度及反应物投料比(
)下,变换后平衡混合气体中CO的体积分数如下表所示:
CO的体积分数/% 投料比
温度/℃
=1
=3
=5
200
1.70
0.21
0.02
250
2.73
0.30
0.06
300
6.00
0.84
0.43
350
7.85
1.52
0.80
①从表中数据可以得到控制不同条件时CO的转化率的变化规律。能使CO的转化率升高,可改变的条件是 、 。
②温度是一氧化碳变换工艺中最重要的工艺条件,实际生产过程中将温度控制在300℃左右,其原因是 。
③温度为300℃、
=1时,反应后的平衡混合气体中CO2的体积分数是 。(结果保留3位有效数字)o
难度: 极难查看答案及解析
-
[化学——选修2:化学与技术](15分)某地煤矸石经预处理后含SiO2( 63%)、Al2O3( 25%) 、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用煤矸石的工艺流程如下图所示。

(1)写出“酸浸”过程中主要反应的离子方程式(任写一个): 。
(2)物质X足量时,“转化”过程中发生反应的有关离子方程式为 。
(3)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.7,A13+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得Al( OH)3产品,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续的操作过程是 ,然后再加入CaCO3,调节pHCaCO3若只pH到5.4,过滤得到Al( OH)3 。
(4)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向A1Cl3饱和溶液中不断通入HC1气体,可析出大量A1Cl3·6H2O晶体。结合化学平衡移动原理解释析出晶体的原因: 。
(5)工业上电解冶炼铝的原料用Al2O3而不用A1Cl3其原因是 。电解Al2O3冶炼铝时,阳极材料是 ,阳极需要定期更换,其原因是 。
难度: 困难查看答案及解析
-
[化学——选修3物质结构与性质l(15分)三聚氰胺(
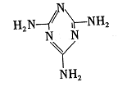 )俗称。蛋白精”,可以由下列反应合成:CaO+3C
)俗称。蛋白精”,可以由下列反应合成:CaO+3CCaC2+CO↑,CaC2+N2
CaCN2+C,CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式: ;CaCN2中阴离子为CN22一,与CN22一互为等电子体的分子有N2O和 (填化学式),由此可以推知CN22一的空间构型为____。
(2)三聚氰胺中氮原子的杂化方式有 。
(3)一些不法商家常在牛奶中加入三聚氰胺和三聚氰酸来提高“蛋白质”的含量,人在摄人三聚氰胺和三聚氰酸(
 )后,两者之间易通过 结合,在肾脏内易形成结石。
)后,两者之间易通过 结合,在肾脏内易形成结石。(4)钙的氧化物有CaO和CaO2两种,其晶胞结构如下图所示,CaO晶体中Ca2+的配位数为 ,Ca2+采取的堆积方式为 。已知CaO2密度是ρg·cm-3,晶胞结构如图所示,则CaO2晶胞中距离最近的两个钙离子间的距离为 cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
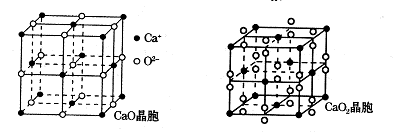
(5)配位化合物K3[ Fe( CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n= 。
难度: 极难查看答案及解析
-
[化学——选修5有机化学基础](15分)某酯M常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。已知M的分子式为C10H10O2且分子中只含有1个苯环,苯环上只有一个取代基。实验测出M的核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:1:1:3。已知M分子的红外光谱如下图:

试回答下列问题。
(1)M的结构简式为 。
(2)G为M的一种同分异构体,其分子结构模型如图所示:
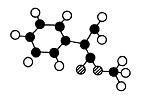
(图中球与球之间连线表示单键或双键)。用芳香烃A为原料合成G的路线如下:

①化合物E中的官能团有 (填名称)。
②A→B的反应类型是 ,E→F的反应类型是 。
③书写化学方程式
C→D E→F
④E的同分异构体甚多,符合下列条件的同分异构体共有 种,试写出符合条件的所有同分异构体的结构简式; 。
i.含有笨环表苯环上有三个取代基;
ii.苯环上的一元取代产物只有两种;
iii.能发生银镜反应但遇FeC13溶液不显色。
难度: 极难查看答案及解析