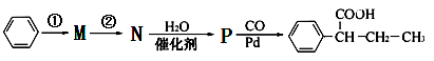-
下列叙述错误的是
A.化学反应能够制造出新的物质,但不能制造出新的元素
B.用Na2S作沉淀剂,可除去废水中的Cu2+和Hg2+
C.玻璃钢是一种合金,广泛用于汽车车身
D.只要符合限量,“食用色素”、“苯甲酸钠”、“亚硝酸盐”可以作为某些食品的添加剂
难度: 中等查看答案及解析
-
下列有关说法不正确的是
A.实验室制取氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解
C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则水电离的热化学方程式为:H2O(l)
H+(aq)+OH-(aq) ΔH= +57.3 kJ·mol-1
D.生铁发生吸氧腐蚀和析氢腐蚀的负极反应均为:Fe-2e- =Fe2+
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列叙述正确的是
A.1.0 L 1.0 mol·L-1的NaClO水溶液中含有的氧原子数为NA
B.25 ℃时1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA
C.2.24 L 的2H35Cl分子中的中子数是1.9NA
D.某密闭容器中盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,形成N—H键的数目为0.6NA
难度: 中等查看答案及解析
-
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2=Fe+2Li2S。下列说法正确的是
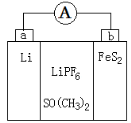
A.该装置将电能转化为化学能
B.Li+向a极移动
C.可以用水代替SO(CH3)2做溶剂
D.b极反应式是FeS2+4Li++4e-=Fe+2Li2S
难度: 中等查看答案及解析
-
溶液X中可能含有K+、Mg2+、Al3+、AlO、SiO、CO、SO、SO中的若干种离子。某同学对该溶液进行了如下实验:
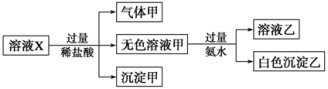
下列判断正确的是
A.气体甲一定是纯净物
B.沉淀乙为Mg(OH)2
C.沉淀甲是硅酸和硅酸镁的混合物
D.溶液X中一定存在K+、AlO
和SiO
离子
难度: 中等查看答案及解析
-
常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是
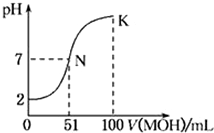
A.HA为一元强酸
B.N点水的电离程度小于K点水的电离程度
C.随着MOH溶液的滴加,比值
不变
D.若K点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol/L
难度: 困难查看答案及解析
-
(14分)“氢能”将是未来最理想的新能源。
Ⅰ 在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为 。
Ⅱ 氢气通常用生产水煤气的方法制得。其中CO(g)+ H2O(g)
CO2(g)+H2(g) △H<0。在850℃时,平衡常数K=1。
(1)若升高温度至950℃,达到新平衡状态时K (填“>”、“<”或“=”)1。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 molCO、3.0mol H2O、1.0 molCO2和x mol H2,则:
①当x = 5.0时,上述平衡向 (填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
③若设x=5.0 mol和x=6.0 mol,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a (填“>”、“<”或“=”)b。
Ⅲ 海水淡化获得淡水的过程也可以产生氢气。下面是利用电渗析法处理海水获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:
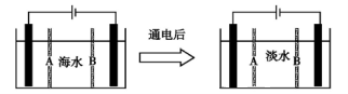
(1)阳离子交换膜是指______________ (填A或B)。
(2)写出通电后阳极的电极反应式:_________________________________________,在阴极区观察到的现象是:_________________________________________。
难度: 困难查看答案及解析
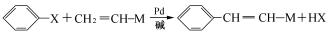 (X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下:
(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下: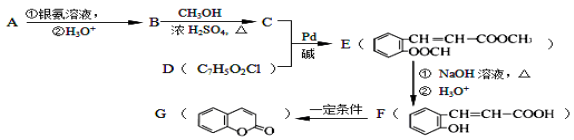
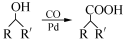 (R,R′为烃基),试写出以苯和丙烯(
(R,R′为烃基),试写出以苯和丙烯(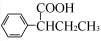 的路线流程图如下:
的路线流程图如下: