-
下列事实不能用勒夏特列原理解释的是
A.热的纯碱溶液比冷的纯碱溶液洗涤油污效果更好
B.配制FeCl3溶液时,在溶液中加入少量稀盐酸
C.等质量粉末状与块状碳酸钙分别与同浓度的盐酸反应,粉末状比块状的反应快
D.新制的氯水在光照条件下颜色变浅
难度: 中等查看答案及解析
-
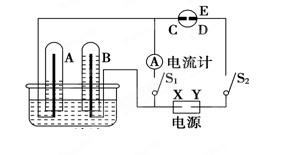
下列各装置中都盛有0.1 mol·Lˉ1 的NaCl溶液,放置一定时间后,纯锌片的腐蚀速率由快到慢的顺序是

难度: 中等查看答案及解析
-
下列反应中生成物的总能量大于反应物总能量的非氧化还原反应是
A.铝热反应 B.氯化铝溶液的水解
C.氢氧化钠和盐酸反应 D.焦炭在高温下与水蒸气反应
难度: 中等查看答案及解析
-
下列说法正确的是
A.CO能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应
B.1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热
C.相同条件下,2mol氢原子所具有的能量大于1mol氢分子所具有的能量
D.101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
难度: 中等查看答案及解析
-
对于反应A2+3B2
2C来说,以下表示的化学反应速率最快的是
A.v (B2)=1.8 mol·L-1·min-1 B.v (A2)=0.4 mol·L-1·s-1
C.v (C)=0.6 mol·L-1·s-1 D.v (B2)=0.42 mol·L-1·s-1
难度: 中等查看答案及解析
-
下列各组热化学方程式中,化学反应的ΔH前者小于后者的是
①C(s)+
O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
②S(g)+O2(g) ===SO2(g);ΔH3 S(s)+O2(g) ===SO2(g);ΔH4
③CaO(s)+H2O(l) ===Ca(OH)2(s);ΔH5 CaCO3(s) ===CaO(s)+CO2(g);ΔH6
A.② B.①② C.①③ D.②③
难度: 中等查看答案及解析
-
惰性电极电解下列溶液,电解一段时间,阴极质量增加,电解液的pH下降的是
A.CuSO4 B.NaCl C.NaOH D.H2SO4
难度: 中等查看答案及解析
-
有一种MCFC型燃料电池,该电池所用燃料为H2和空气,电解质为熔融的K2CO3。电池的总反应为:2H2+O2===2H2O,负极反应:H2+CO32--2e-===H2O+CO2。下列说法正确的是
A.电路中的电子经正极、熔融的K2CO3、负极后再到正极,形成闭合回路
B.电池放电时,电池中CO32-的物质的量将逐渐减少
C.正极反应为2H2O+O2+4e-===4OH-
D.放电时CO32-向负极移动
难度: 中等查看答案及解析
-
某温度下,体积一定的密闭容器中进行如下反应:2X(g)+Y(g)
Z(g)+W(s) ΔH>0,下列叙述正确的是
A.在容器中加入氩气,反应速率不变
B.加入少量W,逆反应速率增大
C.升高温度,正反应速率增大,逆反应速率减小
D.将容器的体积压缩,可增大单位体积内活化分子的百分数,有效碰撞次数增大
难度: 中等查看答案及解析
-
在容积一定的密闭容器中,进行可逆反应N2(g)+3H2(g)
2NH3(g) ΔH<0,有图Ⅰ、Ⅱ所示的反应曲线(T表示温度,P表示压强,C%表示NH3的体积分数),下列说法中不正确的是

A.T2<T1
B.P2>P1
C.若P3<P4,y轴表示N2的转化率
D.若P3>P4,y轴表示NH3的体积分数
难度: 中等查看答案及解析
-
某温度下,已知反应mX(g)+nY(g)
qZ(g) ΔH<0,在一定体积的密闭容器中达到平衡,其他条件不变,下列叙述正确的是
A.若将容器体积变为原来一半,c(Z)为原来的1.8倍,则m+n<q
B.该反应达到平衡时,加入Y,该反应的ΔH改变增大
C.升高温度,c(Y)/c(Z)的值减小
D.使用催化剂,就可反应完全
难度: 中等查看答案及解析
-
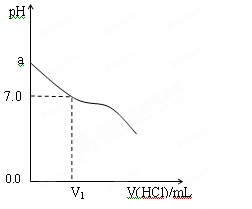
常温下,pH=13的强碱溶液和pH=2的强酸溶液混合,所得溶液的pH=11,则强碱溶液和强酸溶液的体积之比为
A.1∶9 B.9∶1 C.1∶11 D.11∶1
难度: 中等查看答案及解析
-
下列有关实验原理或实验操作正确的是
A.用蒸馏水湿润的pH试纸测量某溶液的pH=10
B.用25mL的酸式滴定管量取14.80mL的NH4Cl溶液
C.向铁钉上镀铜时,铁钉连接直流电源的正极
D.用10 mL量筒量取0.5000 mol·L-1 H2SO4溶液5.50 mL
难度: 中等查看答案及解析
-
向0.1 mol·L-1醋酸溶液中逐滴加入氨水至过量时,溶液的导电能力将发生相应的变化,其电流强度随加入氨水的体积(V)变化的曲线关系是下图中的
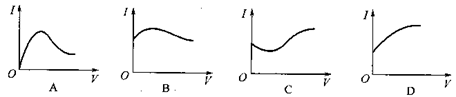
难度: 中等查看答案及解析
-
下列溶液加热蒸干后,能得到溶质本身固体的是
A.FeCl3 B.FeCl2 C.NaOH D.NaHCO3
难度: 中等查看答案及解析
-
下列各组离子中,在由水电离的c(H+)=10-12mol/L的溶液里能大量共存,并且溶液为无色透明的是
A.K+、MnO4-、Cl-、SO42- B.Na+、SO42-、NO3-、Cl-
D.Na+、NH4+、NO3-、CO32- D.Na+、HCO3-、NO3-、SO42-
难度: 中等查看答案及解析
-
在下列叙述中,不能说明盐酸是强酸,醋酸是弱酸的是
A.将等体积pH=4的盐酸和醋酸稀释到pH=5的溶液,醋酸所加的水量多
B.氯化钠溶液呈中性,醋酸钠溶液呈碱性
C.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等
D.等体积、相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸pH变大
难度: 中等查看答案及解析
-
有甲、乙、丙三瓶等体积、等物质的量浓度的NaOH溶液,若将甲蒸发掉一半水(设溶质未变);乙中通入一定量的CO2;丙不做任何改变进行对照,以甲基橙作指示剂,用相同浓度的盐酸滴定,分别达到终点消耗盐酸的体积是
A.V甲>V乙=V丙 B.V甲>V丙>V乙
C.V甲=V乙>V丙 D.V甲=V乙=V丙
难度: 中等查看答案及解析
-
常温下,pH值为11的NaOH溶液与pH值为11的CH3COONa溶液中,水电离的c(OH-)之比为
A.1∶1011 B.1∶103 C.1∶108 D.108∶1
难度: 中等查看答案及解析
-
家用炒菜锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不会发生的化学反应是
A.4Fe(OH)2+2H2O+O2=4Fe(OH)3 B.2Fe+2H2O+O2=2Fe(OH)2
C.2H2O+O2+4e-=4OH- D.Fe-3e-=Fe3+
难度: 中等查看答案及解析
-
常温下,0.1 mol·L-1某一元酸(HA)溶液中
=10-8,下列叙述正确的是
A.该一元酸溶液的pH=1
B.该溶液中由水电离出的H+浓度为c(H+)=1.0×10-11 mol·L-1
C.该溶液中水的离子积常数为1.0×10-22
D.在0.1 mol·L-1某一元酸(HA)溶液中,水的电离被促进
难度: 中等查看答案及解析
-
已知在t1、t2温度下水的电离平衡曲线如图所示,则下列说法中不正确的是

A.t1<t2
B.一定温度下,改变水溶液中c(H+)或 c(OH-)的浓度,Kw不会发生变化
C.t2温度pH值为2的HCl溶液中,水电离出的c(H+)=1×10-10mol·L-1
D.将t1温度下0.1 mol·L-1的盐酸稀释,溶液中所有离子的浓度均相应减小
难度: 中等查看答案及解析